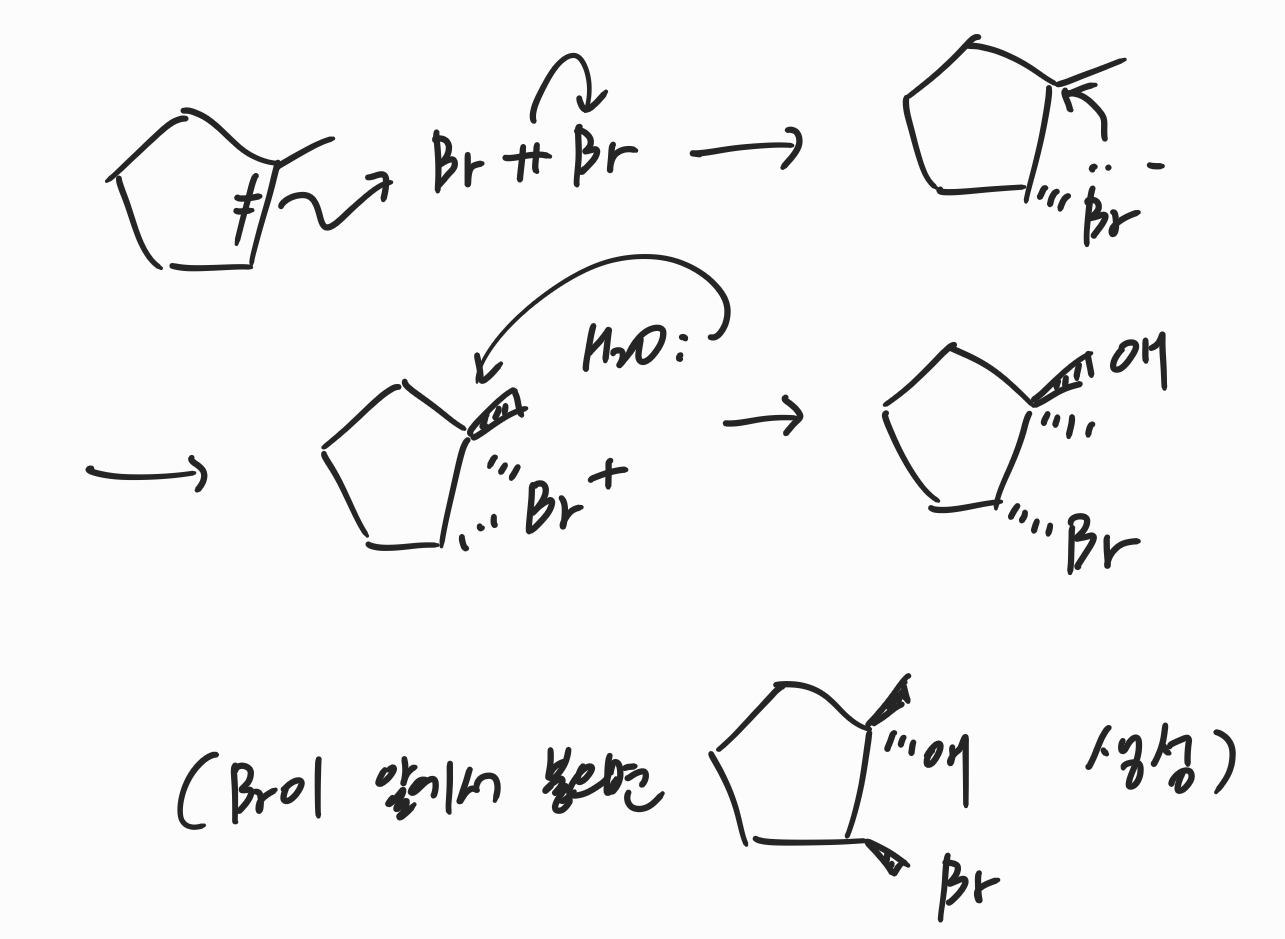
알켄에 BH3.THF(BH3와 THF가 형성하는 complex를 의미합니다.)를 처리하고 이후 H2O2와 -OH를 처리해주면 수소화붕소첨가 산화반응이 일어나며 생성물로 알코올이 생성됩니다. 이 때 BH3.THF가 굳이 아니더라도 BH3를 제공할 수 있는 complex이기만 하면 상관없습니다. 대표적인 complex로는 B2H6가 있습니다. 수소화붕소첨가 산화반응을 진행하면 알켄의 이중결합이 깨지고 수소와 OH가 syn 첨가되는 것을 확인할 수 있습니다. 이 때 입체중심이 존재한다면 라세미 혼합물의 형태로 생성물이 나오게 됩니다. 반응의 메커니즘은 위와 같은데, 먼저 BH3가 complex로부터 분리되어 위처럼 배치되면, 알켄의 이중결합과 BH3의 공유결합이 동시에 깨지면서 H와 BH2가 서로 이웃한 탄소..