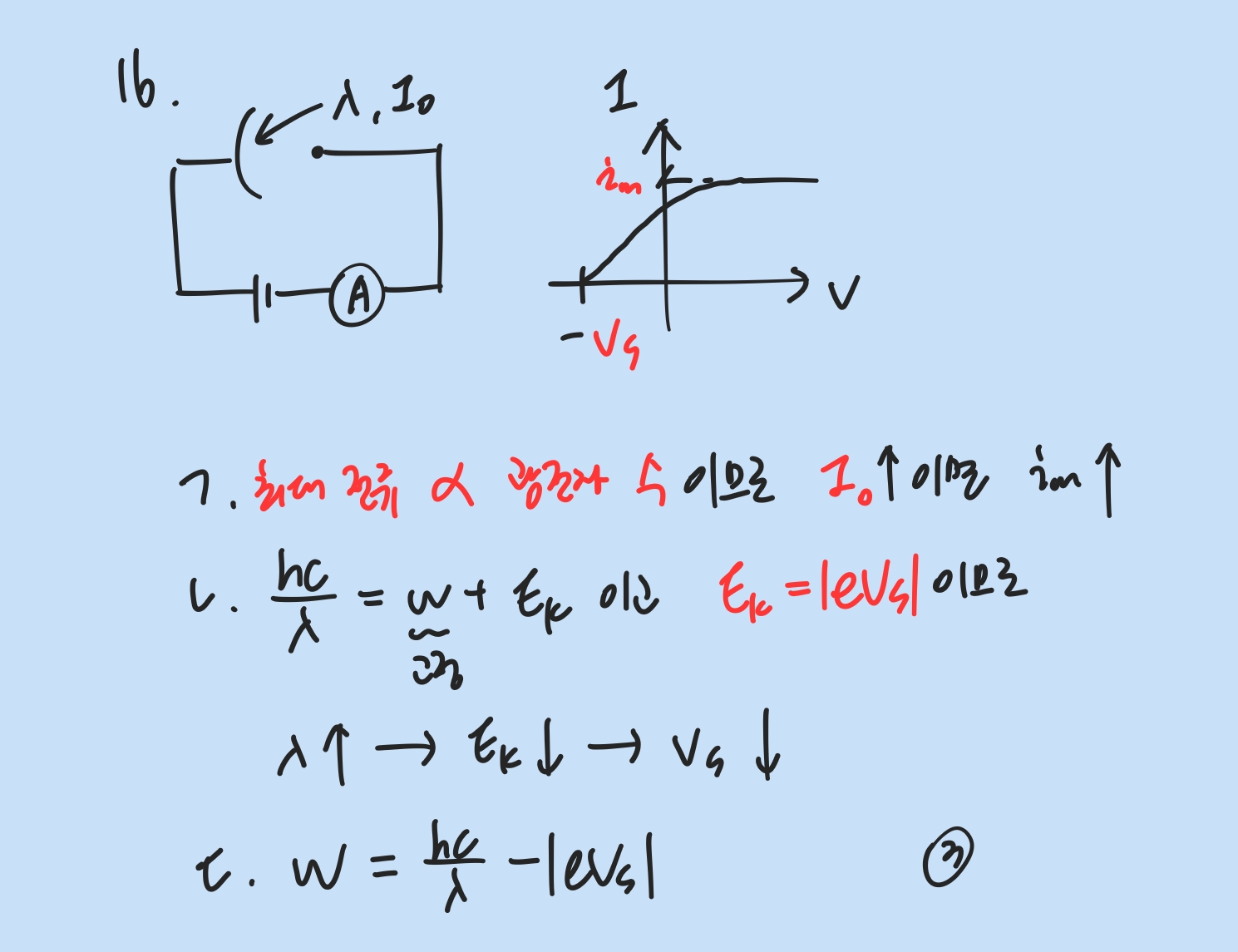
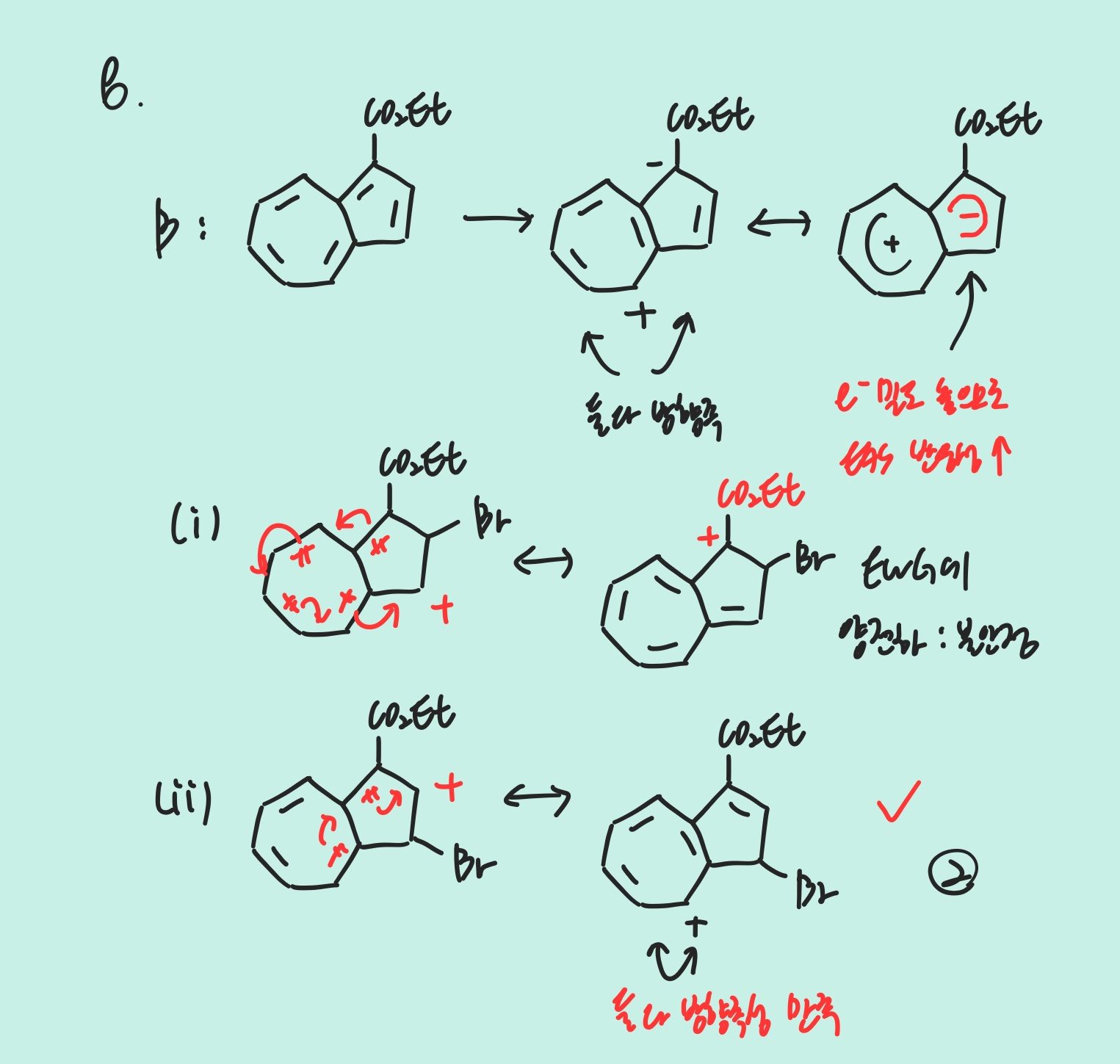
일반화학 - 강장 리간드 = 갈라짐 E ↑ = “흡수” λ ↑ - HX 끓는점 : HF >> HCl F > Br > I - 격자에너지 : 이온 간 거리가 가까울수록 ↑ - 결합의 극성, 쌍극자 모멘트 : 전기음성도로 따진다. (HCl > HBr) - 부피 플라스크는 500mL와 같은 큰 부피 담을 때 / 삼각 플라스크는 가열이 가능 - 극성 용매에서 염기성 : 2차 아민 > 3차 아민 > 1차 아민 유기화학 - 에스터에서 H+은 C=O의 O로 간다 - SNAr : Nu-가 우선 들어가고 공명 구조 거치다가 이탈기 떨어짐 (F > Cl > Br) Benzyne : 먼저 B-가 수소 제거..