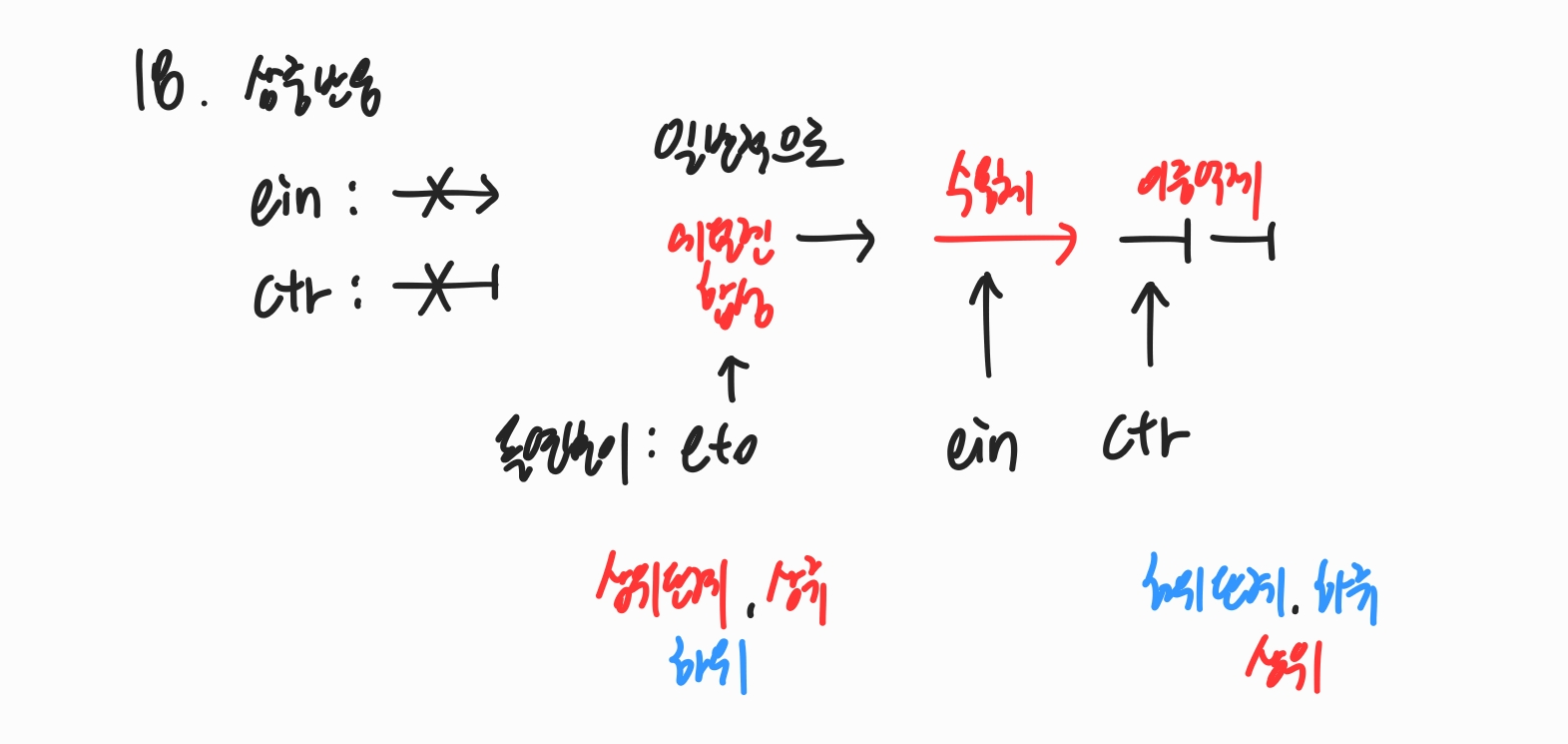
2020학년도 문제들 중에 오답노트식으로 헷갈렸던 보기들만 정리해서 다시 풀어봅니다. 대충 풀어서 도움이 될지는 모르겠습니다. 일반화학 6번 같은 용액에 대해 온도가 변해 밀도가 바뀐다면, 질량이 일정하다는 특성을 이용해 V1d1 = V2d2 식을 활용. 8번 원소들이 섞여있는 화합물 양을 계산할 때는 각 원소를 미지수로 두지말고 YZ2 몰수를 x, XZ 몰수를 y로 두어 소숫점 없이 큰 수로 계산할 수 있도록 한다. 13번 17번 두 용기의 부피가 다른데도 몰수비가 같다면 → △n_g = 0 농도가 큰 쪽의 기체의 분압이 높다. 23번 당량점에서 물질의 몰수를 계산하고 계수비와 몰수비를 이용해서 미지수를 구한다. 유기화학 2번 Z-알켄과 같이 구부러진 구조를 가지면 결정화가 어려워서 녹는점 ↓ (대칭면..