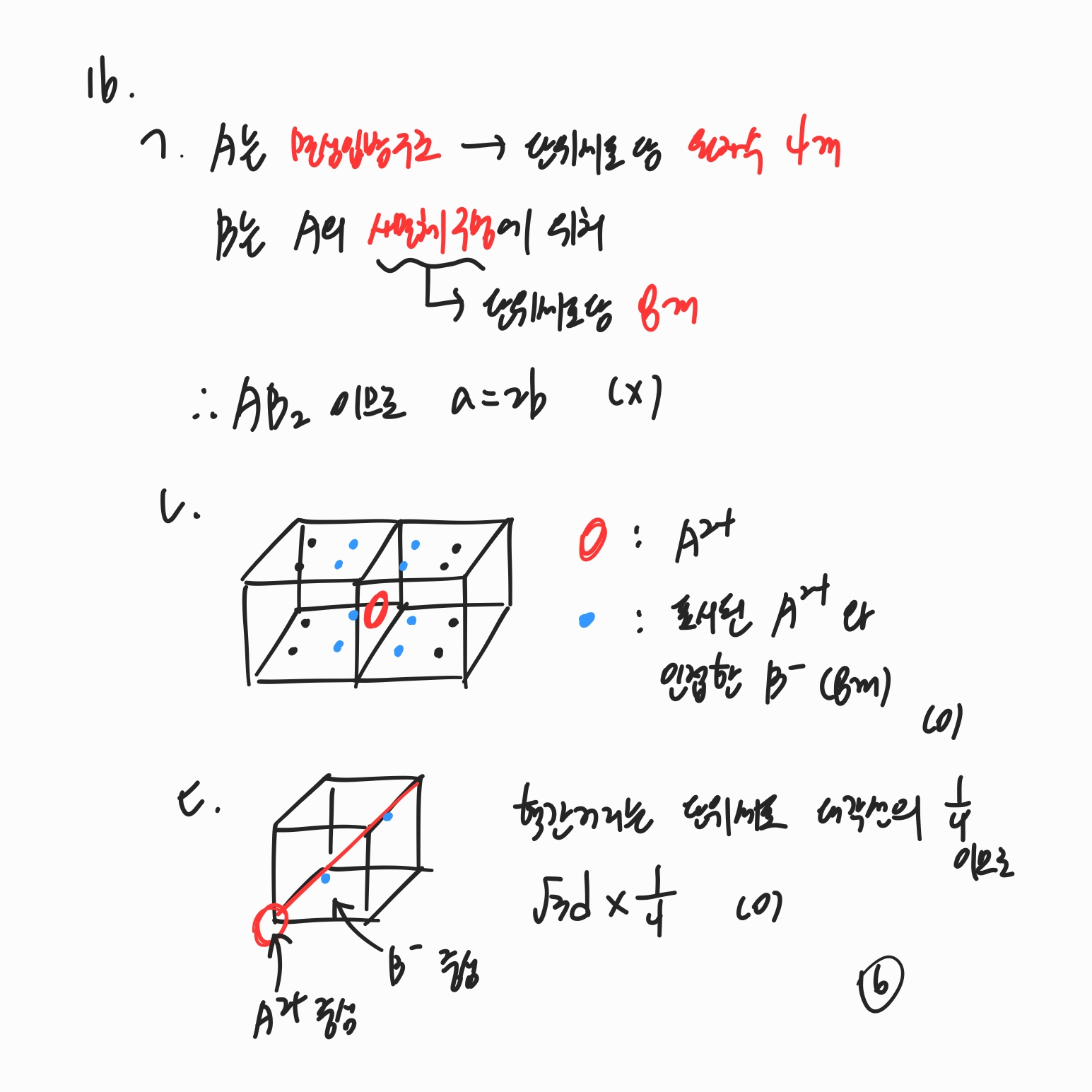
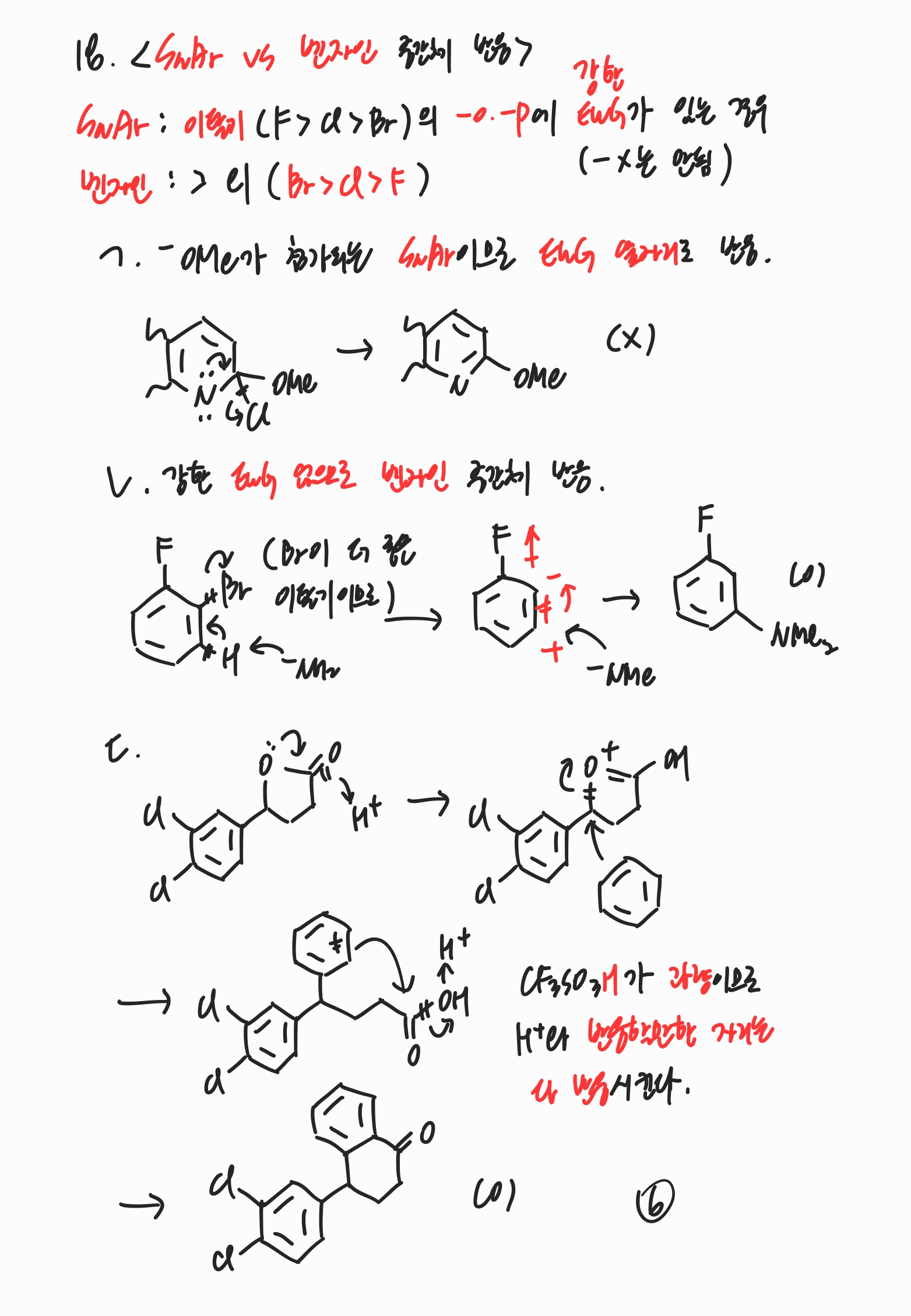
문제와 해설 모두에 저작권이 있어 스스로 풀이한 문제 풀이 노트 필기본만 정리합니다. (제가 개인적으로 보려고 정리합니다.) 3번 삼투압은 iMRT이므로 항상 반트호프인자를 고려해주어야 합니다. iM = 0.02라는 식과 용액의 부피를 알면 용질의 몰수를 알 수 있습니다. x% NaOH 용액에 들어있는 용질의 몰수를 계산할 때는 부피 x 밀도 x 용질의 %값 x 1/(용질 분자량)으로 계산할 수 있습니다. 8번 ② HB + H2O → H3O+ + B-의 K_a 값을 안다면 B-의 K_b 값 또한 계산할 수 있습니다. 그런데 수용액 하에서 K_b 값이 1보다 클 수는 없으므로 모든 염기는 -OH보다 약합니다. ③, ④ pH = 5에서 2[HA] = [HB]이므로 pH = 5의 조건에서 [B-]와 [HB]의..