2015학년도 2번


ㄱ. 원자 반지름이 A가 유독 작으므로 A는 2주기 원소, B, C는 3주기 원소임을 예상할 수 있습니다.
ㄴ. ㄱ에 의해 A는 N, B는 S, C는 Cl임을 알 수 있고 따라서 이온화에너지는 A > B입니다.
ㄷ. 전자친화도는 Cl > S이므로 B < C입니다.
따라서 정답은 1번입니다.
2015학년도 3번


A의 형식 전하가 +2인데 분자 전체 전하가 0이라고 하였으므로 3개의 B는 각각 0, -1, -1의 전하를 가질 것으로 예상할 수 있습니다.
이것은 세 결합이 불균등하다는 의미이므로, 하나는 이중결합임을 알 수 있고 따라서 분자의 대략적인 구조는 위와 같습니다.
①~③ 이 때 단일 결합을 가지는 쪽은 음이온을 형성하므로 분자는 공명구조를 가짐을 예상할 수 있습니다.
따라서 세 결합은 모두 동일하고 분자는 비극성이며, 모든 결합각과 결합 길이는 같습니다.
④ 중심 원자는 비공유 전자쌍을 가지고 있지 않으므로 중심 원자의 혼성 궤도 함수는 sp2입니다.
⑤ 원자가전자 수는 A, B 둘 다 6개로 같습니다.
따라서 정답은 5번입니다.
2015학년도 6번


ㄱ. (나)는 산의 해리가 모두 일어났으나 (가)는 일부만 해리하였으므로 비교적으로 약산입니다.
따라서 pH는 (가) > (나)입니다.
ㄴ. 강산이든 약산이든 당량점까지 필요한 NaOH의 몰수는 같습니다.
(가)와 (나) 모두 HX 또는 HY가 6개 있으므로 두 쪽 모두 NaOH 분자가 6개 필요함을 알 수 있습니다.
ㄷ. HX는 약산이므로 그 짝염기인 X-는 염기성이고, 따라서 NaX는 염기성 염입니다.
따라서 정답은 3번입니다.
2015학년도 9번
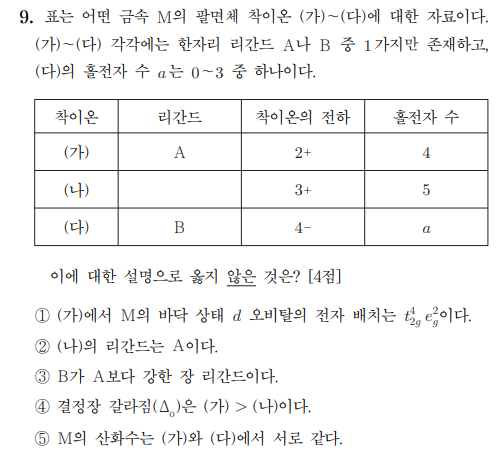

문제에서 중심 금속 M에 대한 팔면체 착물이라고 하였으므로 리간드는 6개가 결합합니다.
따라서 착이온 전하는 중심 금속의 산화수에 +0, +6, -6 중 하나의 값을 더한 전하를 가지게 됩니다.
(가)는 M2+에 중성 리간드 6개가 결합해야 +2의 착이온 전하를 만들 수 있습니다.
(다)는 M2+에 -1의 전하를 가지는 리간드 6개가 결합해야 +4의 착이온 전하를 만들 수 있습니다.
(나)의 리간드 역시 A 또는 B이므로 (나)로 가능한 경우는 M3+의 금속에 중성 리간드 6개가 결합하여 +3의 착이온 전하를 형성하는 경우뿐입니다.
(나)는 M3+이고 홀전자 수가 5개이므로 각 오비탈에 전자가 1개씩 위치하는 경우가 유일합니다.
(가)는 중심 금속의 산화수가 M2+이기 때문에 (나)보다 전자가 1개 더 많고 따라서 위와 같은 배치를 가집니다.
(다)는 M2+이므로 전자가 (가)와 같이 6개인데 홀전자 수 a가 0~3이라고 하였으므로 전자는 low spin을 가지며 그에 따라 a = 0임을 알 수 있습니다.
① 위를 참고하면 t_2g^4 e_g^2임을 알 수 있습니다.
② (나)의 리간드는 A이므로 맞습니다.
③ (다)가 low spin이므로 B는 A보다 강장 리간드입니다.
④ 착이온 전하가 더 큰 (나)가 (가)보다 결정정 갈라짐 에너지가 더 큽니다.
⑤ M의 산화수는 (가), (다) 모두 2입니다.
따라서 정답은 4번입니다.
2015학년도 10번


전하 균형과 계수비를 맞춰주면 되므로 연립방정식을 세우고 풀면 됩니다.
유일하게 주의해야할 점은 aMO4 x-에서 전하는 -ax로 계산해야 한다는 것입니다.
연립하면 a = 2, b = 4, x = 2이므로 정답은 2번입니다.
2015학년도 12번


반쪽 반응식을 먼저 써보고 전지 전위가 양수가 되도록 맞춰주면 표준 전지 전위는 a가 됩니다.
네른스트 식을 작성하면 위와 같이 되며, P_H2와 [Cl-]는 모두 1이기 때문에 생략이 가능하고 나머지를 대입하여 계산해주면 pH = -log[H+] = (b-a) / 0.0592임을 알 수 있습니다.
따라서 정답은 3번입니다.
2015학년도 15번


ㄱ, ㄴ. 어렵지 않게 해결할 수 있습니다.
ㄷ. 식 I, II, III를 모두 더하면 Cl2 + CH4 → HCl + CH3Cl이고 이 때 엔탈피는 -99kJ/mol입니다.
여기서 HCl의 엔탈피만 빼주면 되는데, 문제 조건에서 CH4의 표준 생성 엔탈피가 HCl의 표준 생성 엔탈피보다 17kJ/mol 크다고 하였으므로 이를 참고하여 -17kJ/mol을 전체에서 빼주면 -82kJ/mol임을 알 수 있습니다.
문제 자체는 어렵지 않으나 자료와 보기 외에 문제에서 주는 조건이 또 있는지 살펴보는 것이 중요한 문제였습니다.
문제에서 조건이 모자라다 싶으면 바로 캐치하고 문제를 다시 읽어봐야 합니다.
정답은 5번입니다.
2015학년도 17번


ㄱ. △G = -RTlnK 식을 사용하기 위해 양변을 따로 계산해주면 lnK = 6/5임을 알 수 있습니다.
ㄴ. 표준 깁스 자유에너지가 0일 때 K = 1이므로 K 식을 통해 두 압력의 관계를 알 수 있습니다.
그런데 P_tot = 1atm이므로 각 압력은 1보다 작고, 따라서 제곱하면 더 작아지기 때문에 P_NO2가 더 큼을 알 수 있습니다. (정 헷갈리면 연립해서 각각 구해서 비교해도 됨)
ㄷ. 400K에서 깁스 자유에너지 공식을 이용하여 계산하면 0보다 크므로 보기 ㄷ은 틀렸습니다.
따라서 정답은 3번입니다.
2015학년도 20번


우선 계수비부터 맞춰줘야 문제를 해결할 수 있기 때문에, 간단한 연립방정식을 해결해줍니다.
그 다음 초기에 O2는 몰수가 아닌 압력으로 알려줬기 때문에 계산을 위해 n_O2를 이상기체 상태방정식을 이용하여 정리해줍니다.
그 다음 반응 몰수를 계산해주고 문제에서 알려준 H2O의 몰분율과 연립하여 계산하면 V/R = 600임을 알 수 있습니다.
최종적으로 400K에서의 P_CO2 식을 세우고 R/V = 1/600을 대입하면 P_CO2 = 2/3 atm임을 알 수 있습니다.
따라서 정답은 2번입니다.
2015학년도 21번


ㄱ. (가)에서 P_CO2 < 1atm인 상태에서 평형이 이루어졌으므로, T_1 < 195K임을 알 수 있습니다.
(상평형 그래프에서의 압력은 전체 압력이 아닌 그 기체의 분압임에 유의해야 합니다.)
ㄴ. 강철 용기임에도 기체의 부피가 감소한 것은 고체가 0.01V만큼 늘어났기 때문으로, 온도가 감소한 것임을 알 수 있습니다.
따라서 T2 < T1이고 E_k ∝ T이므로 평균 분자운동에너지는 (가) > (나)입니다.
ㄷ. PV/T가 일정함을 이용하여 식을 세우면 x = 10T_2 / 99T_1 입니다.
(이 때도 마찬가지로 PV/T 일정 공식은 특정 기체의 분압만 가지고도 성립합니다.)
2015학년도 23번


ㄱ. 1M HCl을 250mL 0.1M로 희석하는 과정이므로 x = 25입니다.
ㄴ. 종말점에서 H+의 몰수와 OH-의 몰수가 같다는 성질을 이용하면 MV 일정 공식을 통해 [OH-] = 0.01M임을 알 수 있습니다.
그 다음 반응 농도를 계산해주면 [OH-] = 2s이며, 이것이 0.01M이므로 s = 5 × 10^(-3)임을 알 수 있습니다.
Ca(OH)2의 경우 K_sp = 4s^3이므로 여기에 s를 대입해주면 K_sp = 5 × 10^(-7)입니다.
ㄷ. 남은 Ca2+가 0.1%라는 것은 Ca2+ 농도가 10^(-3)이 되었다는 것이고, 이것을 원래 농도인 5 × 10^(-3)에 곱해주면 Ca2+ 농도가 나옵니다.
이것을 반응 상수로 계산하면 K_sp보다 작으므로 정반응이 더 진행될 것임을 알 수 있습니다.
그러므로 [OH-]는 0.1M보다 커집니다.
따라서 정답은 3번입니다.
2015학년도 24번


ㄱ. K1과 K2 공식을 계산하면 K2 공식에서 [B] = 0.5임을 알 수 있습니다.
그런데 K1 = 4K2이므로 b^2 / a = 2입니다.
ㄴ. 콕을 열면 K2 = [B] = 1/2이고, 이것을 K1에 대입하면 [A] = 1/8입니다.
그런데 V = 2이므로 n_A와 n_B는 2를 곱한 1/4과 1이 됩니다.
따라서 전체 몰수는 이들을 합한 1.25mol이 됩니다.
ㄷ. b^2/a = 2이므로 b = 0.5이면 a = 1/8입니다.
콕을 열면 [A] = 1/16이고, [B]는 오른쪽 구에 있는 0.5mol을 고려하여 1/2M이 됩니다.
이 때 Q는 4로 K1보다 크기 때문에 역반응이 진행될 것임을 예상할 수 있고, 따라서 B는 감소합니다.
B가 감소하면 C가 소모되므로 C는 감소합니다.
따라서 정답은 1번입니다.
2015학년도 25번


ㄱ. 표를 보면 pH가 1 증가할 때마다 반응 속도는 1/100이 되므로 v = k[H+]^2임을 알 수 있습니다.
pH 0에서 [H+] = 1M이기 때문에 pH 0에서 v = k = 5 × 10^(-2)입니다.
H+는 전체 반응에서 2mol씩 소모되므로 적분 속도식에서 k 자리에 2k를 넣어서 식을 만들고 여기서 t = 60을 대입하면 [H+] = 2/13으로 1/10보다 크므로 pH는 1보다 작음을 알 수 있습니다.
ㄴ. 적분 속도식에 t = 15를 대입하면 [H+] = 1/2이 되는데 이것은 H+ 농도가 1.5M 감소했음을 말하고 이는 H+가 0.15mol이 반응했다는 의미이므로 생성된 H2는 소모 H+의 절반인 0.075mol임을 알 수 있습니다.
ㄷ. 2M HA와 반응하면 K_a = x^2 / (2-x) = 5 × 10^(-7)이고, x = [H+] = 10^(-3)이므로 용액의 pH는 3이 됩니다.
표를 참고하면 pH가 3일 때 v = 5.0 × 10^(-8)입니다.
따라서 정답은 4번입니다.
'자연과학(PEET) > 일반화학' 카테고리의 다른 글
| [PEET 일반화학] 2017학년도 7회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.22 |
|---|---|
| [PEET 일반화학] 2016학년도 6회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.21 |
| [PEET 일반화학] 2014학년도 4회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.19 |
| [PEET 일반화학] 2013학년도 3회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.17 |
| [PEET 일반화학] 2012학년도 2회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.17 |