반응식

다중결합이 나오지 않고 알케인 내에서만 나올 수 있는 유기화학반응은 라디칼 치환반응뿐입니다. sp3 탄소와 연결된 수소에 빛 에너지 또는 열을 가해주고 할로젠족 X2와 반응시키면 sp3 C-X의 치환 반응이 일어납니다. sp2 탄소나 sp 탄소에 연결된 수소와는 반응이 일어나지 않습니다.
반응이 가능한 할로젠 X2는 Cl2, Br2가 있으며 Cl2 대신에 NCS, Br2 대신에 NBS를 사용하기도 합니다.
예시

대표적으로 위와 같은 연쇄반응이 가능합니다. 위의 반응식들에는 중요한 특징이 있는데, CH2Cl2, CHCl3, CCl4는 모두 밀도가 1보다 큰, 즉 H2O보다 밀도가 큰 용매입니다. 따라서 반응을 통해 얻어진 CH2Cl2 같은 경우는 아래로 가라앉는 용액을 분별해서 받아내야합니다. 그러나 아무래도 위의 반응들은 연쇄적으로 일어나기 때문에, 결국 CCl4가 가장 수득률이 높은 생성물이 될 것입니다.

단일 반응식의 경우 위와 같은 라디칼 치환반응을 예시로 들 수 있습니다. Cl이 다른 수소가 아닌 3차 탄소의 수소에 치환반응이 일어나는 이유는, 중간체인 라디칼이 3차 탄소에 존재할 때 가장 안정하기 때문입니다. 즉, 중간체가 가장 안정한 방향으로 반응이 일어난 결과 위와 같은 치환반응이 일어난 것입니다.
메커니즘
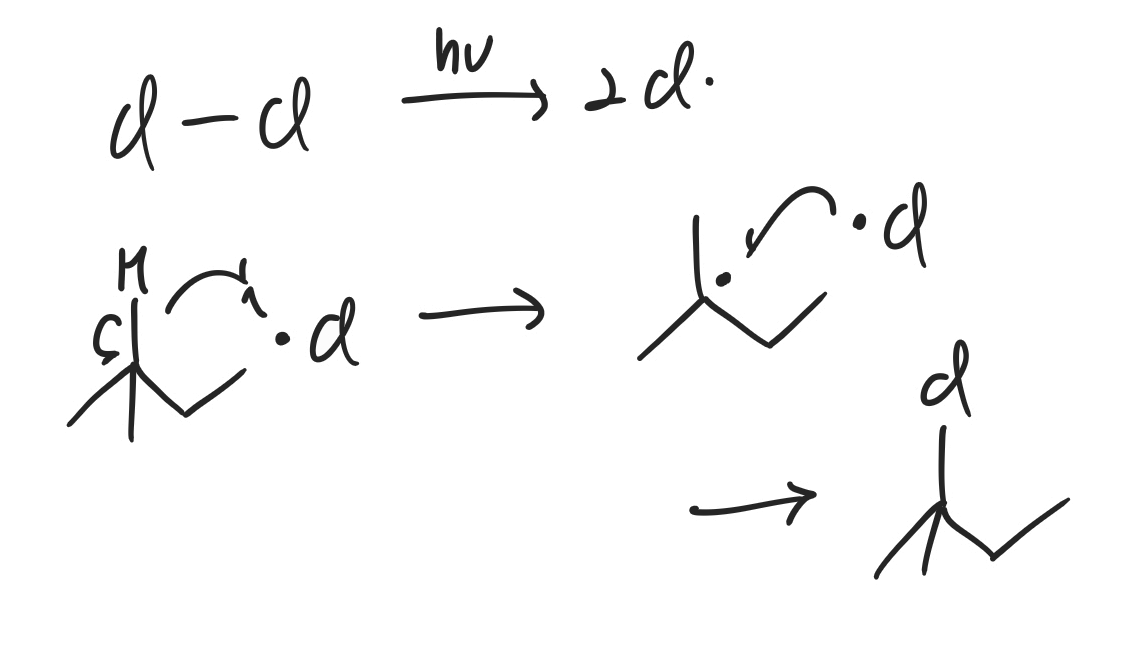
라디칼 반응은 사실 메커니즘의 중요도는 낮지만, 참고용으로 위와 같은 메커니즘을 그렸습니다. 위에서 말했듯 3차 탄소 라디칼이 중간체로 생성되는 것을 알 수 있고, 따라서 Cl은 3차 탄소에 붙게 됩니다. Markovnikov's rule을 따르는 생성물이라고 할 수 있습니다.
예제

위와 같은 반응식의 생성물을 예상해보세요. 힌트는 NCS는 Cl2 대신에 치환반응에 사용될 수 있는 시약이라는 것입니다.

정답은 위와 같습니다. 2차 Benzyl 탄소 라디칼은 매우 안정하므로 (3차 탄소 양이온만큼이나 안정함) Cl이 붙는 자리는 해당 탄소가 될 것이고, 이후 Cl이 붙게 된다면 입체 중심이 되기 때문에 오른쪽과 같이 라세미 혼합물이 생성될 것입니다.

위와 같은 반응식의 생성물을 예상해봅시다. 힌트를 주자면 반드시 높은 차수의 탄소에 붙는 것이 아니라, 라디칼의 공명구조에 대해서도 고려를 해보아야 합니다.
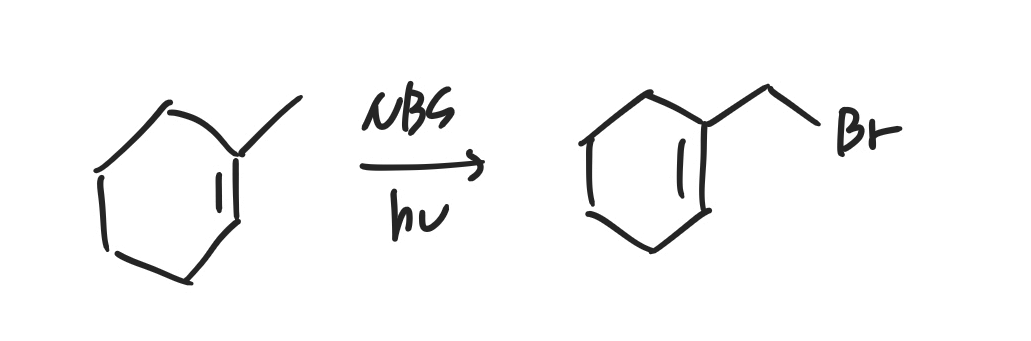
정답은 위와 같습니다. 라디칼의 공명구조를 그려보면 맨 오른쪽 위 탄소에 라디칼이 생성되는 경우가 있는데 해당 탄소에 붙을 때 steric이 가장 작기 때문에 Br이 오른쪽과 같이 1차 탄소임에도 붙게되는 것입니다.

위와 같이 반응을 시켰을 때 얻어지는 생성물의 비가 100:1일 때, 3차 탄소에 붙어있는 수소와 1차 탄소에 붙어있는 수소의 반응성의 비를 구해봅시다.
이러한 문제는 3차 탄소의 수소와 1차 탄소의 수소의 개수비를 구해서 계산해줘야 합니다. 왜냐하면, 개수가 많으면 그만큼 반응할 확률이 높아지기 때문입니다. 대략적으로 한 분자에 있는 3차 탄소의 수소와 1차 탄소의 수소의 비를 구해보면 1:9이므로, 반응성의 비는 100/1 : 1/9 = 900 : 1임을 알 수 있습니다. 즉, 3차 탄소의 수소의 반응성이 1차 탄소의 수소에 비해 900배의 반응성을 가집니다.
'자연과학(PEET) > 유기화학' 카테고리의 다른 글
| [알켄] 할로젠화반응 (Halogenation) (0) | 2021.02.10 |
|---|---|
| [알켄] 라디칼첨가반응 (+ Anti-Markovnikov's rule) (1) | 2021.02.10 |
| [알켄] 할로젠화수소첨가반응 (Hydrohalogenation) (+ hydride shift와 alkyl shift) (1) | 2021.02.10 |
| [알켄 제법] 할로젠화수소제거반응 (Dehydrohalogenation to Alkene) (0) | 2021.02.10 |
| [알켄 제법] 산촉매탈수반응 (Dehydration) (0) | 2021.02.10 |