문제

위와 같이 용해도곱상수 K_sp, 산의 이온화상수 K_a, 평형상수 K와 pH에 따른 성분의 농도 변화 그래프를 주었을 때 보기의 옳고 그름을 판별하는 문제를 풀이해봅시다.
풀이

우선 문제에서 주어진 상황에서의 용해도곱 상수 등을 이용하여 식을 세워보면 위와 같은 정보를 알 수 있습니다. 이 때 pH나 온도가 변화하면 평형 상수 값이 변화할 수 있기 때문에 문제에서 상태가 어떻게 변화하는지를 살펴보아야 합니다.

보기 ㄱ은 같은 조건에서의 반응의 평형 상수를 구하는 문제이므로 위에서 가진 식을 가지고 연립하여 보기에 주어진 반응식의 평형 상수 식을 만들어야 합니다. 따라서 위와 같이 연립을 두어 번 정도 해주면 a의 값을 쉽게 구할 수 있습니다.

보기 ㄴ은 생각을 많이 해야하는데요, [A2+] 값과 [B2+] 값이 급격히 변화한다는 것은 반응이 시작되었다는 말이므로 해당 이온들의 농도가 들어간 반응식들을 살펴보면, A2+를 기준으로 위와 같은 식에서 역반응이 일어난다는 것을 알 수 있습니다. 즉, Q 값이 K 값보다 커야만 역반응이 시작되므로, 부등식을 세워서 확인해주어야 합니다.

따라서 위와 같이 Q 값에 대한 식을 놓고 이 값이 K보다 커지는 순간 [A2+]값이 감소한다는 식을 두고 계산을 해주면 그 때의 pH가 6임을 알 수 있습니다. 따라서 r=6이라는 정보를 얻어낼 수 있습니다.

B에 대해서도 같은 방법을 수행해주면 (반응식을 세우고 평형상수 식을 계산한 뒤 Q 값이 K보다 커야 역반응이 진행된다는 조건식을 세우면) 똑같이 q 값을 구할 수 있습니다. 계산하면 q=3이 얻어지고, 따라서 r-q=3이라는 식이 성립하므로 보기 ㄴ도 맞음을 확인할 수 있습니다.
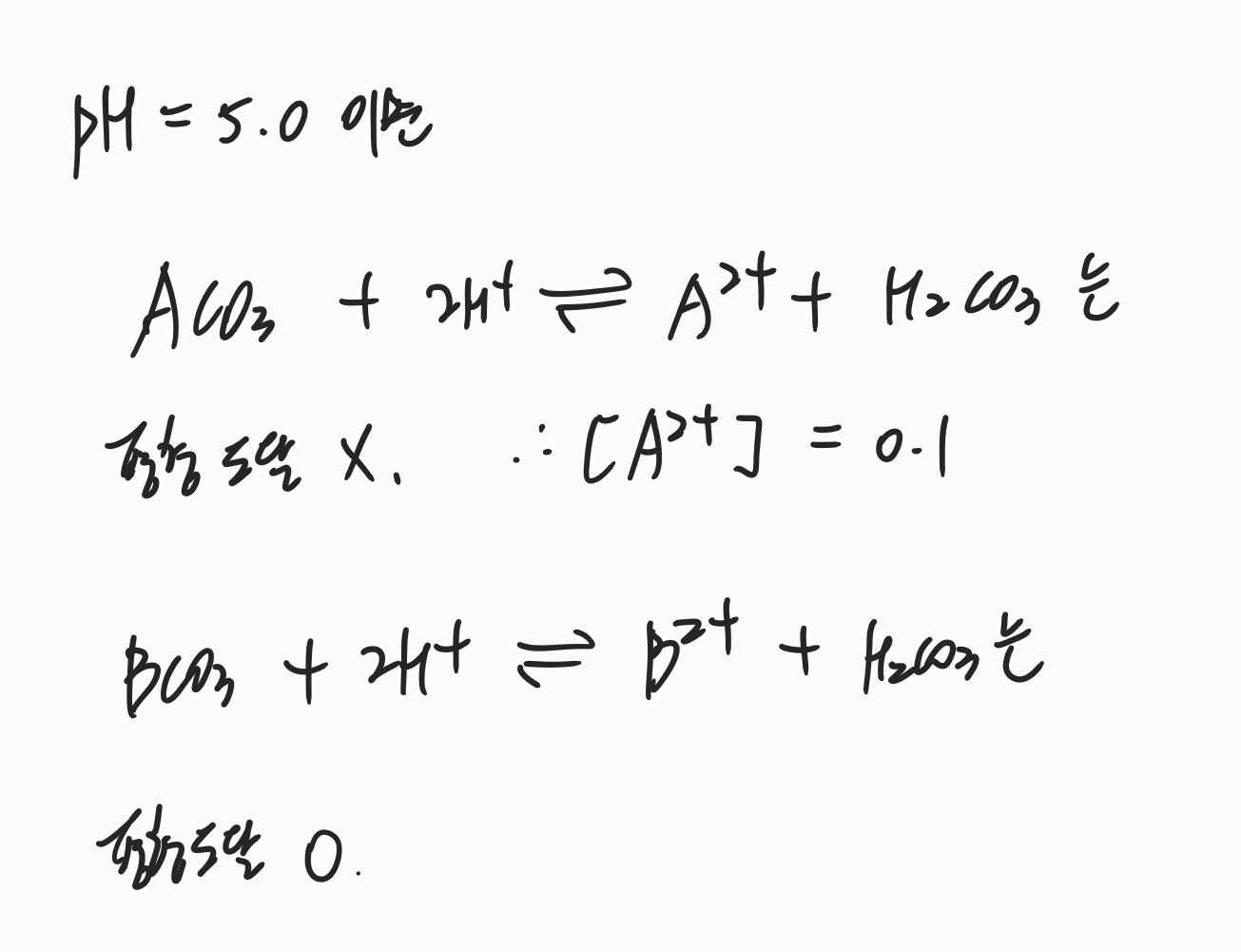
보기 ㄷ에서는 pH가 5.0일 때의 상황을 묻고 있는데 평형이 이동할 수 있기 때문에 보기 ㄴ에서 구한 정보를 활용해야합니다. 문제에서 주어진 꺾이는 log 그래프 자체가 평형이 깨지며 [A2+]값과 [B2+]값이 변화하는 정보를 주고 있기 때문에 pH = 5.0 지점에서 어떻게 되는지 살펴봐야 합니다.
확인해보면 A에 대한 반응식은 평형에 아직 도달 안했기 때문에 반응 초기에 주어진 농도인 0.1mol로 고정이 되고 B에 대한 반응식은 평형에 도달했기 때문에 K 값을 이용해 계산해야 합니다.

따라서 위와 같이 계산해보면 [B2+]값은 10^(-5)임을 알 수 있고 따라서 pH 5에서 주어진 식을 계산하면 보기의 값과 다르다는 것을 알 수 있습니다. 따라서 보기 ㄷ도 틀렸습니다.
따라서 맞는 보기는 ㄱ과 ㄴ이고 정답은 4번입니다.
'자연과학(PEET) > 일반화학' 카테고리의 다른 글
| [기체] 피스톤과 연결된 기체가 혼합될 때의 엔트로피와 에너지 구하기 (2013학년도 20번 풀이) (0) | 2021.02.28 |
|---|---|
| [기체] 피스톤으로 압축한 후 생성물의 몰수를 구하는 문제 (2020학년도 11번) (0) | 2021.02.28 |
| [상평형] 강철 용기 내에서 온도를 낮추며 증기압을 측정하는 문제 (2018학년도 24번 풀이) (0) | 2021.02.27 |
| [상평형] 평형점을 주고 온도를 변화시켜 일부 승화시키는 문제 (2015학년도 21번 풀이) (0) | 2021.02.27 |
| [증기압] 액체가 섞인 실린더에서 압력을 구하는 문제 (2016학년도 8번 풀이) (0) | 2021.02.27 |