반응식

알카인에 할로젠화수소를 2당량만큼 첨가하면 같은자리 이할로젠화물이 나옵니다. 물론 1당량만큼만 처리할 경우 삼중결합 중 하나가 깨지며 알켄이 만들어집니다.
예시

위의 반응식과 같이 butyne에 2당량의 HCl을 처리하였더니 오른쪽과 같이 같은 탄소에 Cl이 두 개 붙어있는 2,2-Dichlorobutane이 만들어지는 것을 확인할 수 있습니다. 염화수소를 1당량만큼만 처리할 경우 2-Chlorobutene이 만들어집니다. 중간 과정은 아래에 정리해두었습니다.
메커니즘

할로젠화수소첨가반응은 알켄에서도 있었던 반응이기 때문에 메커니즘 자체는 그와 동일합니다. 다만 알카인에서 알켄이 되는 과정은 메커니즘이 정확히 규명되지 않았기 때문에 전자 이동을 한 번에 표현하였습니다. 이후 알켄에서 첨가반응이 일어나는 과정은 알켄의 공유전자쌍이 H를 데려가고 남은 Cl이 남은 자리인 탄소 양이온에 가서 결합하는 과정이므로 같습니다.

조금 생각해보면 어차피 오른쪽 탄소의 수소가 떨어지나 왼쪽 탄소의 수소가 떨어지나 똑같이 2차 탄소 양이온이 생성되는 것은 마찬가지인데 왜 오른쪽 탄소의 수소는 떨어지지 않는지 의문점이 들 수 있습니다. 이것은 반응을 더 진행시켜보면 확인할 수 있습니다. 오른쪽 탄소의 수소가 제거되는 경우 이후 Cl이 전자쌍을 제공, 삼각고릴 형성한 뒤 SN2 반응을 통해 남은 Cl-가 첨가되어야 하는데, 중간체에 해당하는 Cl 삼각고리가 strain이 커서 상대적으로 불안정합니다. 따라서 왼쪽 탄소 양이온이 중간체로 형성되는 것입니다.
예제

할로젠화수소첨가반응은 알켄의 반응 파트에서도 했었기 때문에 간단하게 하나의 예제 반응식만 보고 넘어가도록 하겠습니다. 위의 반응식에 대한 결과물을 예상해보세요. NO2의 성질과 그로 인해 발생하는 현상(특히 중간체)에 대해서 잘 생각해보아야 합니다.

일반적인 할로젠화수소첨가반응이라면 NO2가 붙어있는 탄소에 Cl이 첨가되어야 하지만, 실제로 정답은 위와 같습니다. 그렇다면 불안정한 중간체가 만들어짐에도 불구하고 오른쪽 탄소가 양이온이 된다는 것인데 그 이유는 무엇일까요?
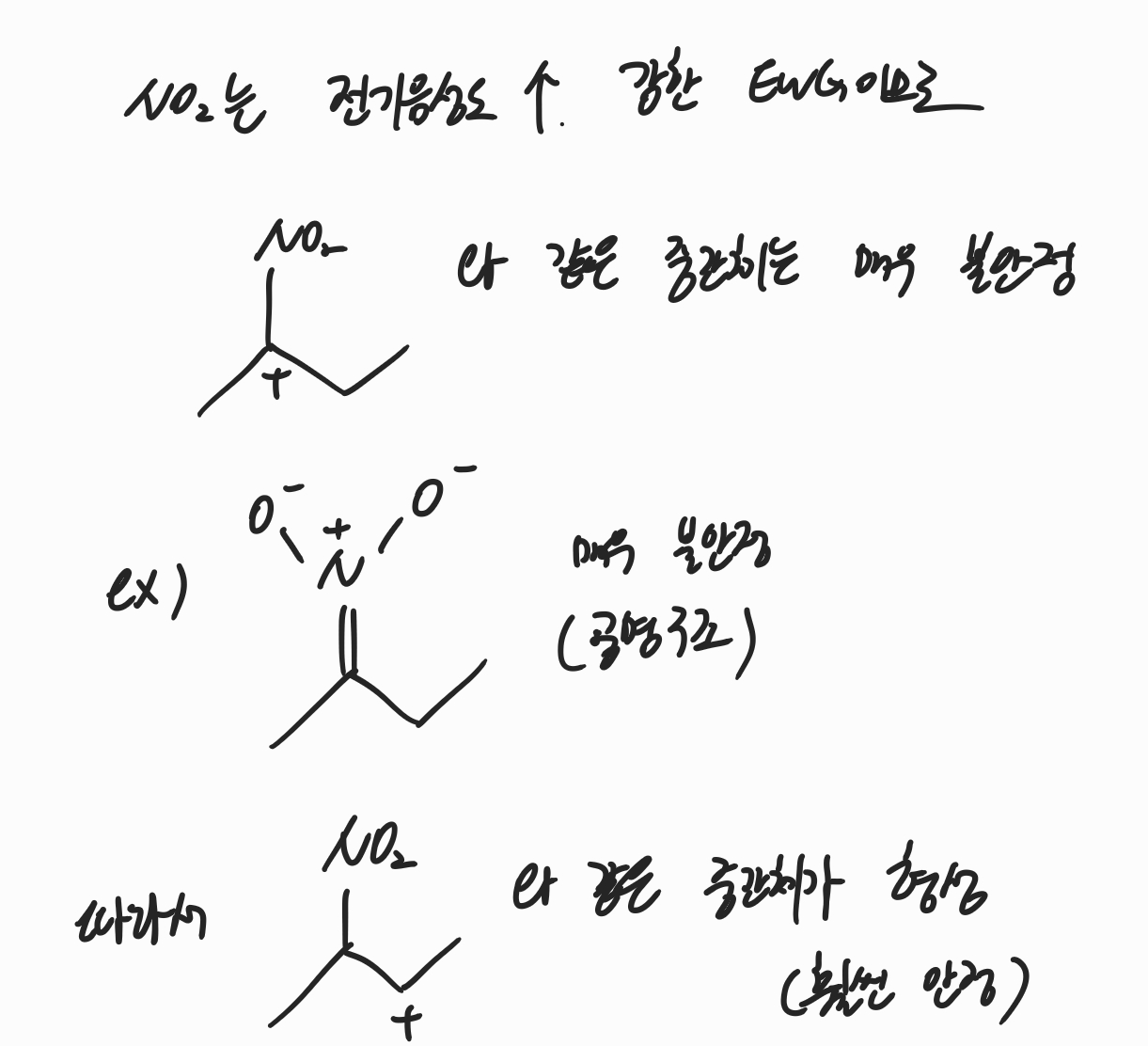
그 이유는 NO2가 전기음성도가 높아 EWG(electron withdrawing group, 전자를 뺏는 치환기)이기 때문입니다. 조금 더 자세히 이야기해보자면 만약 왼쪽 탄소에 양이온이 형성된다면 아래 그림과 같이 질소가 양이온이 되는 공명구조(또는 산소가 양이온이 되는 공명구조)가 발생하게 됩니다. 이것은 전기음성도가 높은 NO2 group으로써는 굉장히 불안정한 상태이기 때문에, 이러한 중간체가 형성되지 않는 것입니다. 따라서 탄소 양이온은 맨 아래와 같은 형태로 형성되며, 따라서 Cl은 오른쪽 탄소에 붙게 됩니다.
'자연과학(PEET) > 유기화학' 카테고리의 다른 글
| [알카인] 할로젠화반응 (Halogenation of Alkyne) (0) | 2021.02.15 |
|---|---|
| [알카인] 라디칼첨가반응 (Radical addition of Alkyne) (0) | 2021.02.15 |
| [알카인 제법] 할로젠화수소제거반응 (Dehydrohalogenation to Alkyne) (0) | 2021.02.14 |
| [알켄] 고분자화반응 (Polymerization) (0) | 2021.02.14 |
| [알켄] 1,2-diol 산화성분해반응 (0) | 2021.02.14 |