반응식

버치 환원 반응이란, 방향족 화합물을 환원시켜 pi bond의 전자를 수소와 결합시켜 시그마 결합으로 바꾸는 반응입니다. 따라서 환원제인 Li, Na, K 등의 금속 원소와 NH3, 그리고 알코올이 순서대로 필요합니다. 금속원소/NH3는 라디칼 중간체를 만들기 위한 전자 첨가에 사용되며, 알코올은 이후 수소를 제공하기 위해 필요합니다.
이 때 중요한 점은, 방향족 고리 내에서 1쌍의 전자쌍이 결합에 제공되면 남은 두 개의 이중 결합이 육각 고리 내에 가능한 배치는 3가지가 있는데, 이 배치가 고리의 치환기가 EDG냐 EWG냐에 따라서 달라진다는 것입니다. 이에 대한 배치는 위의 반응식에 그려져 있으며, 메커니즘이 아래에 정리되어 있습니다.
예시

다음과 같은 예시 반응이 가능합니다. 벤젠에 Li/NH3을 통해 전자를 첨가해주고, 이후 만들어지는 탄소 음이온에 알코올이 수소를 제공하는 역할을 합니다. 메커니즘은 아래에 정리되어 있습니다.
메커니즘
메커니즘은 크게 다음의 세 가지로 분류됩니다.
(1) EDG나 EWG가 없을 때

만약 벤젠 고리의 치환기에 EDG나 EWG가 둘 다 없는 경우, 가운데 남은 두 개의 이중 결합의 배치는 최대한 떨어져있기만 하면 위치 자체는 아무렇게나 가능합니다. 따라서 금속 원소에 의한 전자 첨가 후 공명 구조를 가지다가, 알켄이 맞은 편에 형성된 이후 수소를 받아들여 아래와 같은 구조를 가지게 됩니다.
(2) 치환기 중 EDG가 있을 때
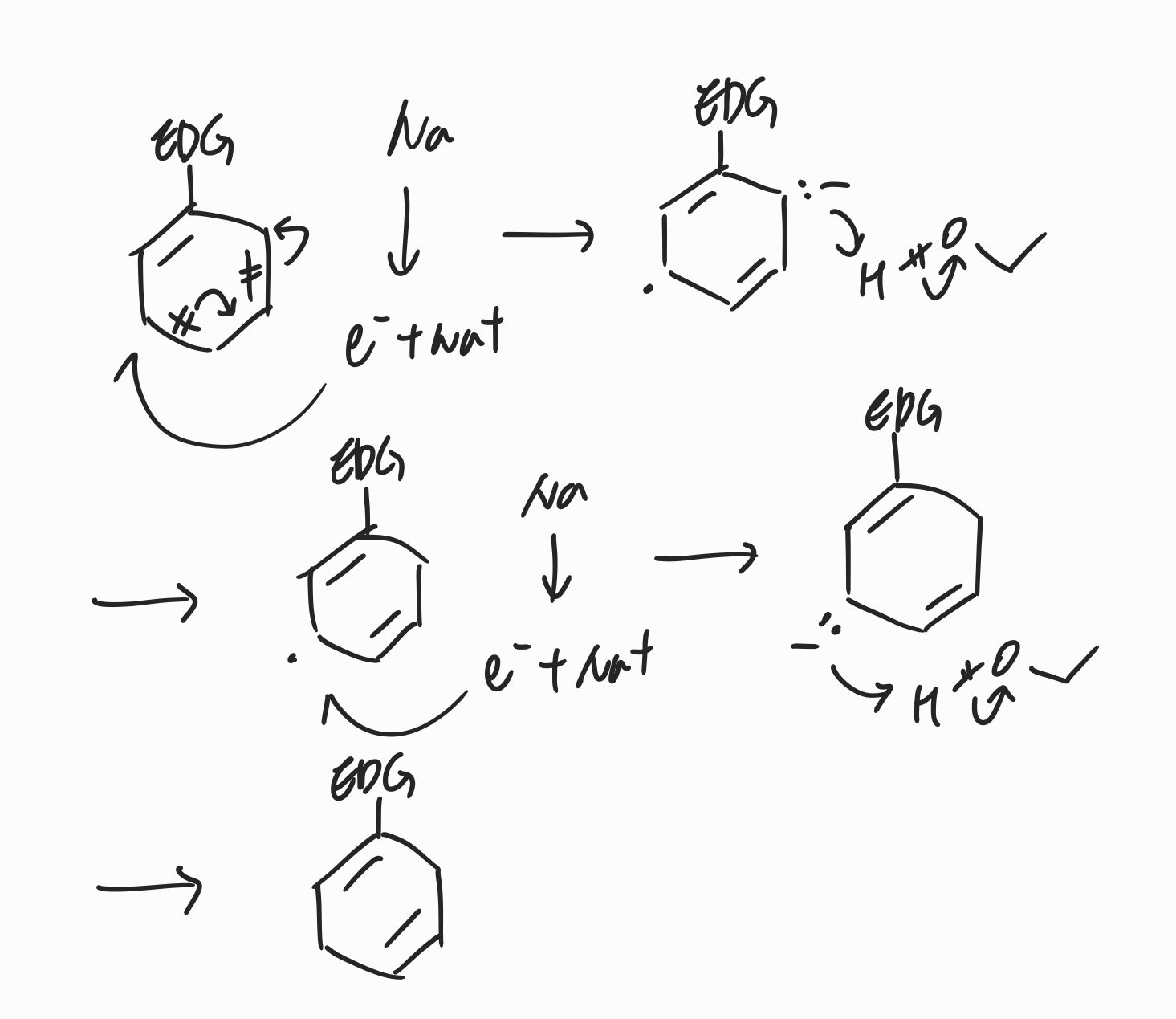
치환기들 중 전자를 제공하는 치환기인 EDG가 있을 때에는 위의 메커니즘을 보면 알 수 있듯, EDG와 연결되어있는 탄소에 음이온이 생기면 매우 불안정하기 때문에, 다이엔이 EDG가 붙어있는 탄소와 연결되어 형성됩니다. 이후 나머지 수소를 받아들여 결합이 형성되고 나머지 반대쪽도 전자 첨가로 음이온 형성, 알코올에 의한 수소 첨가가 순서대로 진행되며 가장 아래에 있는 모양과 같은 다이엔이 형성됩니다.
(3) 치환기 중 EWG가 있을 때
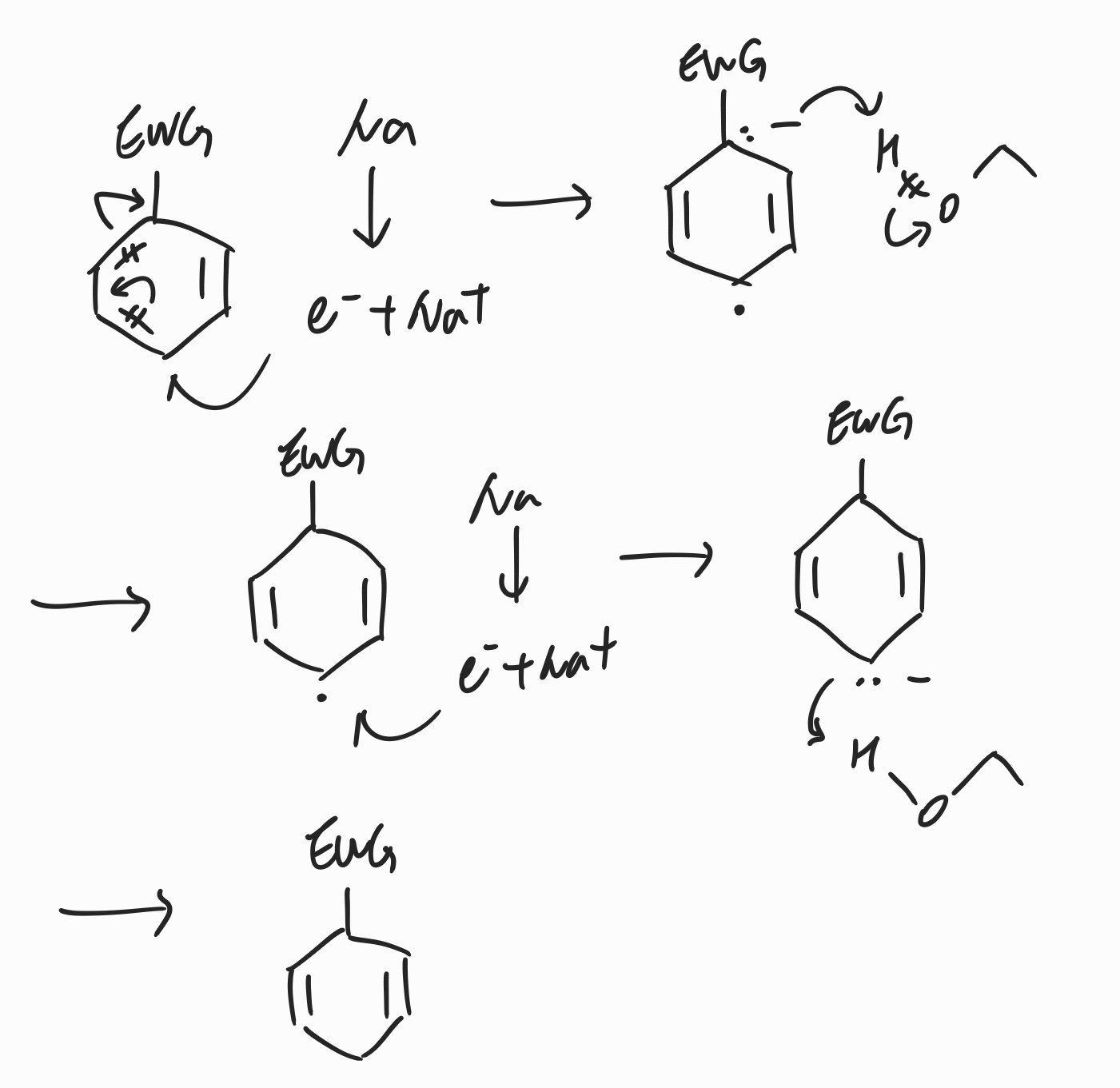
메커니즘 자체는 치환기 중 EDG가 있는 경우와 매우 비슷하지만, EWG가 있는 경우 음이온이 EWG가 붙어있는 탄소에 형성되는 것이 상대적으로 안정하기 때문에 EWG 탄소에 음이온이 형성된 채로 수소를 받아들이게 됩니다. 그러면 다이엔은 자연스럽게 EWG 쪽 탄소와 떨어져서 생기고, EWG로부터 나머지 반대쪽 탄소가 음이온 형성, 수소 첨가가 순서대로 진행되면서 아래쪽에 있는 분자의 형태를 가지게 됩니다.
예제

위와 같은 반응식의 생성물을 예상해봅시다. NO2가 EDG인지 EWG인지 그리고 버치 환원 생성물의 형태를 알고 있다면 쉽게 해결할 수 있습니다.

NO2는 EWG이므로 오른쪽과 같은 형태의 버치 환원 생성물이 나옴을 예상할 수 있습니다.

위와 같은 반응식의 생성물을 예상해봅시다. 메틸기와 SO3H의 성질을 파악한 뒤 가장 최적의 구조로 다이엔을 배치해야합니다.

정답은 위와 같습니다. 메틸기는 EDG에 해당하고 SO3H는 EWG에 해당하므로 3가지의 다이엔 배치를 그려보면, 두 치환기의 성향을 만족하는 최적의 다이엔 배치가 위와 같이 유일함을 알 수 있습니다. 따라서 오른쪽 위와 같은 생성물이 얻어지게 됩니다.
'자연과학(PEET) > 유기화학' 카테고리의 다른 글
| [알코올] Grignard 반응 (+ Grignard 시약) (0) | 2021.02.19 |
|---|---|
| [알코올] 알코올의 산화, 환원 반응 (Alcohol oxidation/reduction) (+ 반응 시약) (0) | 2021.02.19 |
| [방향족 화합물] 방향족 곁사슬 산화반응 (Aromatic Side chain Oxidation) (0) | 2021.02.19 |
| [방향족 화합물] 벤자인이 중간체로 등장하는 반응 (Benzyne) (0) | 2021.02.18 |
| [방향족 화합물] 친핵성 방향족 치환반응 SNAr (Nucleophilic Aromatic Substitution) (0) | 2021.02.18 |