2021학년도 12번


분자의 루이스 구조를 그리는 문제입니다.
이온의 형식 전하에 대해서 표에 정리되어 있는데, 이 때 이 형식 전하를 중심 원자 I의 형식 전하로 보아도 무방합니다.
따라서 이를 바탕으로 분자 구조들을 그리면 위와 같습니다.
ㄱ. (나)의 형식 전하는 -1, (다)의 비공유 전자 수는 3이므로 a + b = 2입니다.
ㄴ. (다)의 분자 구조는 직선형이므로 틀렸습니다.
ㄷ. (가)의 I의 혼성 궤도함수는 sp3이고, 이 때 s-character는 25%입니다.
(나)의 I의 혼성 궤도함수는 d2sp3이고, 이 때 s-character는 약 17%입니다.
따라서 보기 ㄷ은 틀렸습니다.
따라서 정답은 5번입니다.
2021학년도 16번
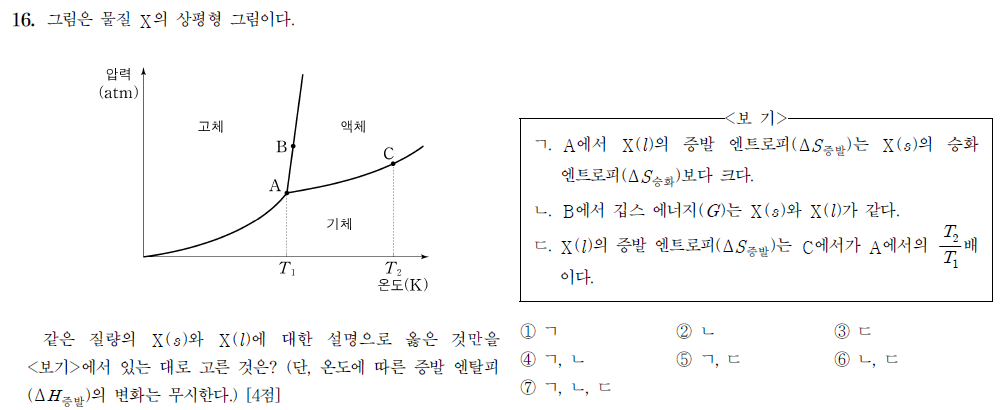

상평형 그래프 해석에 대한 문제입니다.
ㄱ. A에서 X(l)의 증발 엔트로피와 X(s)의 승화 엔트로피에 대해 비교하기 위해, 두 상황에서의 △G 값을 생각해보면 둘 다 평형 상태이므로 △G = 0입니다. 따라서 위처럼 식을 쓰고 엔탈피를 비교하면 승화 엔트로피가 더 작을 수밖에 없음을 알 수 있습니다.
ㄴ. B에서는 고체와 액체가 평형을 이루고 있는 상황이므로 두 G 값은 같음을 알 수 있습니다.
ㄷ. A와 C에서는 모두 기체와 액체가 상평형을 이루는 △G = 0인 상태이므로, 위와 같은 식을 이끌어낼 수 있습니다.
따라서 식을 넘겨 적절히 정리하면 보기 ㄷ이 틀렸음을 알 수 있습니다.
따라서 정답은 2번입니다.
2021학년도 18번


우선 (나)에서 증가한 물질은 X, Y이고, 감소한 물질은 Z인데, 반응물이 2개인데 2가지 물질이 증가했다는 것은 추가 투입한 A와 생성물 C가 증가한 것임을 유추할 수 있으므로 Z는 B임을 알 수 있습니다.
또한 세 물질 모두 0.1M이 증가하거나 감소했으므로 반응 계수 b와 c는 같음을 알 수 있습니다.
(i) b=c=1, X=A라고 가정하고 반응 전과 후 K_c 값을 구해보면 두 값이 다르므로 가정이 틀렸음을 알 수 있습니다.
(ii) b=c=1, X=C라고 가정하고 반응 전과 후 K_c 값을 구해보면 두 값이 일치하므로 가정이 맞음을 알 수 있습니다.
ㄱ. b=c=1이므로 b+c=2입니다.
ㄴ. 반응 전후 몰수를 계산한 뒤 연립해보면 y=0.1이므로 x=0.2임을 알 수 있습니다.
ㄷ. K_c는 위에서 계산한대로 10입니다.
따라서 정답은 6번입니다.
2021학년도 21번


그래프를 보면 A의 반감기가 길어지고 있으므로, A에 대한 2차 반응임을 알 수 있습니다.
또한 B는 A의 농도에 의존하여 변화하므로 전체 반응속도는 B의 농도와 무관함을 알 수 있습니다.
ㄱ. 반응속도가 B의 농도와 무관하다는 것은 B에 대해 0차 반응임을 의미하므로, b=0입니다.
ㄴ. v = k[A]^2이므로 전체 반응 차수는 2입니다.
ㄷ. A에 대해 적분 반응속도식을 쓴 뒤 아무 좌표나 잡아서 대입하면 k = 5/2임을 알 수 있습니다.
이후 v_0 식에 k 값과 [A]_0 값을 대입하여 계산하면 초기 반응속도는 0.1임을 알 수 있습니다.
따라서 정답은 6번입니다.
2021학년도 22번


문제에서 K2SO4 수용액을 전기분해한다고 하였으므로 초기 수용액에는 K+, SO4 2-, H2O가 존재하고 있음을 인지하고 문제를 풀어봅시다.
0.004f의 전하로 0.003mol의 기체가 생성된다고 하였으므로 가능한 경우는 2H2와 O2가 생성되는 경우밖에 없습니다.
(그 외의 경우에는 계수비가 안 맞아서 불가능함)
따라서 산화 반쪽 반응식은 2H2O → O2 + 4H+ + 4e-이며, 환원 반쪽 반응식은 4H2O + 4e- → 2H2 + 4OH-입니다.
ㄱ. 위의 내용을 참고하면 맞습니다.
ㄴ. H2O의 환원 전위가 K+ 환원 전위보다 높았기 때문에 반쪽 반응이 일어난 것이므로, 맞습니다.
ㄷ. 환원 전극이라고 하였으므로 기체의 생성은 곧 H2의 생성을 의미합니다.
H2는 전자 2mol당 1mol이 생성되므로, 위의 식대로 계산해주면 3/f mol이 생성됩니다.
따라서 정답은 7번입니다.
2021학년도 23번


ㄱ. 중화점이 염기성 환경이므로 [OH-]에 대한 공식을 사용해주도록 합니다.
당량점까지 사용된 NaOH의 몰수가 2mmol이고, 100mL를 가해주었기 때문에 용액의 부피는 200mL가 되었음을 인지하여 농도를 구하면 c = 0.01이므로 K_b = 10^(-8)이고, 따라서 K_a = 10^(-6)입니다.
ㄴ. 주어진 공식은 K_a 값의 비로도 계산할 수 있으므로, HA의 K_a 값을 구하도록 합니다.
HA는 NaOH 50mL 지점에서 당량점에 도달하였고, 이 때 -OH는 총 1mmol이 가해졌으므로 HA는 초기에 1mmol 존재하였음을 알 수 있습니다.
반당량점에서 pH = pK_a라는 성질을 이용하면 HA의 pK_a는 4임을 알 수 있습니다.
따라서 주어진 식의 값은 10^2임을 알 수 있습니다.
ㄷ. Q는 NaOH 1.6mmol이 가해진 지점이므로, HB는 0.4mmol이, B-는 1.6mmol이 남습니다.
따라서 헨더슨-하셀바흐 식을 적용하면 pH = 6 + log4가 됩니다.
따라서 정답은 2번입니다.
2021학년도 24번


ㄱ. 우선 평형 I부터 반응물과 생성물의 몰수를 계산해보면, 주어진 몰수비와 부피비를 이용하여 x와 c 값을 계산할 수 있습니다.
c = 2이므로 보기 ㄱ은 틀렸습니다.
ㄴ. K_I를 부피까지 고려하여 계산해주면 8/3V^2이 됩니다.
그 다음 평형 II에서 반응물과 생성물의 몰수를 계산해준 뒤, 역시 주어진 몰수비와 온도비를 기반으로 부피비를 구하여 계산해주면 K_II = 16/3V^2으로 보기 ㄴ의 조건이 맞음을 알 수 있습니다.
ㄷ. 평형 I에서 II로 갈 때 온도가 증가하였는데 K_c 평형이 오른쪽으로 이동하였으므로 정반응이 흡열 반응임을 알 수 있습니다.
따라서 정답은 6번입니다.
2021학년도 25번


ㄱ. 마지막 반응식은 첫 번째 반응식의 정반응 + 세 번째 반응식의 역반응에 해당하므로 K 값을 적절히 나누어주면 10^9임을 알 수 있습니다.
ㄴ. 그래프를 x축의 오른쪽에서 왼쪽으로 해석해보면 H+가 증가함에 따라 A2+ 또는 B2+가 증가하다가 0.1M에 고정된다고 생각할 수 있습니다.
먼저 A2+일 때 CO3 2-의 농도를 구해주고, 이를 기반으로 H+의 농도를 구해 pH를 구하면 6입니다.
그 다음 B2+일 때도 마찬가지로 CO3 2-의 농도, H+의 농도를 계산하면 pH가 3입니다.
따라서 q = 3, r = 6이므로 r-q = 3임을 알 수 있습니다.
ㄷ. 그래프에서 pH = 5에서 [A2+] = 0.1M이므로, B2+의 농도만 계산하면 됩니다.
pH = 5에서 CO3 2-의 농도는 2 × 10^(-9)이고, 이를 기반으로 B2+의 농도를 계산하면 10^(-5)이므로, 두 이온의 농도비는 10^(-4)입니다.
따라서 정답은 4번입니다.
'자연과학(PEET) > 일반화학' 카테고리의 다른 글
| [PEET 일반화학] 2012학년도 2회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.17 |
|---|---|
| [PEET 일반화학] 2011학년도 1회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.17 |
| [PEET 일반화학] 2020학년도 10회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.08 |
| [PEET 일반화학] 2019학년도 9회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.08 |
| [PEET 일반화학] 2018학년도 8회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.06.06 |