생체 고분자와 중합반응
생명을 구성하는 분자들은 많은 고분자로 이루어져 있고, 이 고분자는 중합체를 이루는 단위인 monomer, 단량체로 이루어져 있습니다. 단량체들은 각각 공유결합을 하고 있고 이 연결되는 반응을 중합반응이라고 하며, 이 때 일반적으로 중합반응의 결과로 H2O 한 분자가 배출됩니다. (탈수축합반응)
ex ) 탄수화물의 경우 단당류 여러 개가 중합반응을 통해 연결되어 다당류를 구성하고 있고, 이들은 각각 글리코시드 결합을 구성하고 있습니다.
중합반응 중에서 H2O가 배출되지 않는 예외 반응으로는 글리코겐 분해 반응이 있는데, 글리코겐 분해 반응의 경우에는 가수분해가 아닌 인산기를 첨가하여 분해됩니다. 글리코겐에는 환원 말단 한 개와 비환원 말단 여러 개가 존재하는데, 인산기를 전달하면 포도당이 떨어지면서 나옵니다.
작용기
작용기는 생명과학, 유기화학을 한다면 필수로 알아야 할 내용입니다. 생체 분자 내에는 다양한 작용기가 있는데, 그 종류와 특성을 반드시 알아야 합니다.
- OH (hydroxy기)
친수성을 가집니다. 예를 들어, 아미노산 중 티록신의 경우 벤젠 고리와 OH기를 가지고 있는데 이 중 OH기로 인해 해당 부분은 친수성을 가집니다. 그러나 분자가 너무 큰 경우에는 OH기를 가지더라도 친수성을 띠지 않을 수 있습니다. 예를 들어 콜레스테롤의 경우 탄소 육각고리 3개와 오각고리 1개로 이루어져 있는데, 육각고리 중 한 개는 OH기를 가지고 있습니다만, 콜레스테롤이 친수성을 가진다고 말하지는 않습니다.
또한 OH기가 있으면 OH기가 있는 두 개의 분자가 서로 탈수 축합 반응을 일으킬 수 있습니다. 두 개의 OH기 중에서 O 1개와 OH 1개가 떨어져 H2O가 배출되고, 나머지끼리 연결이 될 수 있는 것입니다.
가장 중요한 예시로는 인산기의 탈수축합반응이 있는데, -OH기와 인산기의 -OH가 반응하여 탈수 축합 반응을 일으키게 되면, 물질을 활성화 시킬 수 있게 됩니다. 이것은 크게 세 가지로 활용이 되는데, 첫 번째로는 인산기가 탈수 축합 반응을 통해 여러 물질을 거쳐 전달되면서 각 물질을 활성화시키면서 "신호 전달"의 기능을 가지는 것입니다. 두 번째로는 "효소의 활성/비활성을 조절"하는 것입니다. 다만 효소에 인산기가 붙었을 때 효소가 활성이 되는 경우도 있고, 붙어서 비활성이 되는 경우도 있습니다. 예를 들어 Glycogen Phosphorylase에 인산기를 붙이면 활성이 되고, Glycogen Synthase에 인산기를 붙이면 비활성화가 됩니다. 세 번째 기능은 "연결"입니다. 예를 들어 Nucleotide 여러 개를 연결할 때 각 Nucleotide의 사이에 인산기가 들어가서 연결을 매개해줍니다.
- CO (carbonyl기)
Carbonyl기는 분자의 끝에 있느냐 중심에 있느냐에 따라 다른데, Carbonyl기가 분자의 끝에 존재하는 경우 (-CHO) aldehyde기로, 중간에 존재하는 경우 (-CO-) ketone기라고 부릅니다. H2O가 많은 환경에서는 반응을 통해 ketone기도 aldehyde기가 됩니다. Carbonyl기는 특성상 산화가 잘 되기 때문에 환원제로 작용할 수 있습니다.
- COOH (caboxyl기)
Carboxyl기는 양성자를 방출할 수 있기 때문에 산으로 작용합니다.
지금까지의 작용기들을 산화/환원 상태로 비교해보면, 환원이 잘 되어있는 순서부터 산화가 잘 되어있는 순서로 배열을 해보면 포화탄화수소 < alcohol < carbonyl < carboxyl 입니다. 환원이 잘 되어있다는 말은 합성이 잘 되어있다는 말과 같은 의미이기도 하고, 반대로 산화가 잘 되어있다는 의미는 그만큼 분해가 잘 되어있다는 의미이기도 합니다. 즉 이 산화/환원 순서에 따라 물질이 합성/분해되어 있습니다.
- NH2 (amino기)
아미노기는 이전에 아미노산 구조에 대해 잠깐 다루었을 때에도 나왔던 내용이지만, NH2의 경우 H+를 받아들여 NH3+의 구조를 가질 수 있기 때문에, 염기로 작용합니다.
- PO4 2- (phosphaste기, 인산기)
인산기의 경우 핵산에는 존재하지만 아미노산에는 없는 구조이고, 생체 내에서 활용되는 경우는 앞에 있는 방사성 동위원소 파트에서도 다뤘었지만 alpha-32P의 경우 인산 에스테르 결합(분자 사이의 연결)에 사용되고, gamma-32P의 경우 신호 전달 또는 효소 활성화에 사용됩니다.
참고로 아미노기와 인산기는 모두 친수성의 성질을 가지고 있습니다.
- SH (thiol기, 황화수소기)
바로 윗줄에서 언급했지만 위에 있는 작용기들은 모두 친수성의 성질을 가지고 있으나, SH기의 경우에는 친수성을 가지지 않는 소수성을 가지고 있습니다. 또한 SH기는 2개의 cysteine 사이에서 이황화결합, disulfide 결합을 구성한다는 특성이 있습니다. ( 2 -SH -> 2H+ + -S-S-) 이 이황화결합은 단백질의 3차 구조를 구성하는데 중요한 역할을 하는 결합입니다.
다만 이황화결합은 역으로도 반응이 되는데, 즉 S-S 결합을 끊을 수 있는데, 여기에는 두 가지 물질만이 사용됩니다. 환원제에 해당하는 D.T.T(Dithiothreitol)또는 beta-ME(beta mercaptoethanol)가 사용됩니다.
이것이 응용되는 개념에는 NEM이 있는데, NEM은 -SH기에 가서 공유결합을 하는 분자입니다. 단백질이 3차 구조를 형성하고 있을 때, 이황화결합이 이루어진 부분도 있을 것이고(-S-S-), 이황화결합이 이루어지지 않은 두 개의 thiol기(2 -SH)도 있을 것입니다. 이것을 구분할 수 있는 방법으로 방사성 동위원소를 처리한 NEM*과 처리하지 않은 NEM을 순서대로 처리하는 방법이 있습니다.
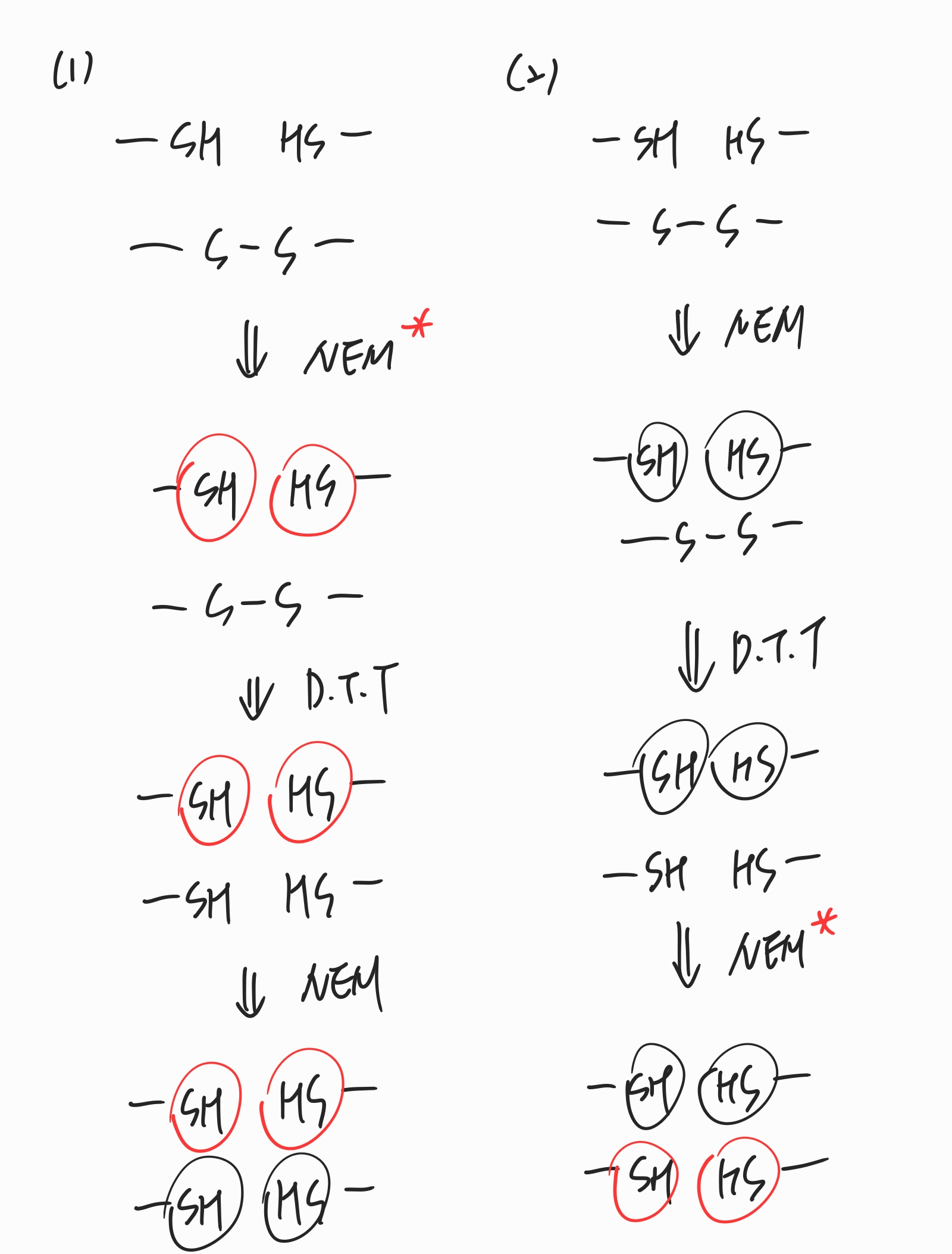
(1) NEM* (방사성 동위원소를 처리한 NEM) -> D.T.T -> NEM 순으로 처리를 한 경우
D.T.T를 처리하기 이전 NEM을 방사성 동위원소를 처리하여 반응시키는 경우, NEM*은 이황화결합이 이루어지지 않은 thiol기에만 반응을 할 것이고, 이후 D.T.T를 처리하여 이황화결합을 산화시킨 뒤 방사성 동위원소를 처리하지 않은 NEM을 반응시키면 이황화결합이 끊어지고 만들어진 -SH기에 NEM이 처리되어 구분이 가능해집니다. 방사성 동위원소가 검출되는 NEM이 결합된 SH기는 이황화결합을 구성하지 않은 SH기이고, 방사성 동위원소가 검출되지 않는 NEM이 결합된 SH기는 이황화결합을 구성하고 있던 S임을 알 수 있습니다.
(2) NEM -> D.T.T -> NEM* 순으로 처리를 한 경우
NEM은 이황화결합이 이루어지지 않은 SH기에 결합을 하고, D.T.T 처리를 하면 이황화결합이 끊어지고, 다시 방사성 동위원소를 처리한 NEM*을 반응시키면 이황화결합을 하고 있던 S에서만 방사성 동위원소가 검출이 됩니다.
결론적으로 어디에 방사성 동위원소를 표지시킬 것인지의 차이일 뿐이지 둘 다 구분은 가능합니다.
- CH3 (methyl기)
메틸기는 DNA 또는 DNA 결합 단백질에 결합하여 유전자 발현에 (응축시킴으로써) 영향을 준다는 특성이 있습니다. 예를 들어 DNA의 methylation은 유전자의 전사율(DNA -> RNA 전사)을 감소시킵니다.
'자연과학(PEET) > 생명과학' 카테고리의 다른 글
| [세포생물학] 탄수화물 : 이당류(α/β 글리코시드 결합), 올리고당, 다당류 분류 및 특성 (0) | 2021.01.26 |
|---|---|
| [세포생물학] 탄수화물 : 단당류의 분자 구조와 특성 / 6탄당 유도체 (글루코사민, 갈락토사민 등) (0) | 2021.01.25 |
| [세포생물학] 구조/기하/광학이성질체와 생체내에서의 예시 (탈리도마이드, 파킨슨병 등) (0) | 2021.01.23 |
| [세포생물학] 체내 pH 변화에 따른 항상성 교란 (+ 그래프 해석) (0) | 2021.01.22 |
| [세포생물학] 아미노산 완충 구간과 등전점 / 아미노산 용액 적정 그래프 해석 (0) | 2021.01.22 |