문제

전기화학 파트 문제입니다. 두 개의 갈바니 전지에 대한 반쪽 반응식을 주고 일부를 미지수로 두었다고 할 때, 주어진 pH에 따른 환원전위의 그래프만 가지고 변수를 찾는 문제를 해결해봅시다.
풀이

먼저 산화 전극의 반쪽 반응식과 환원 전극의 반쪽 반응식이 모두 환원 반응식으로 주어졌기 때문에 어떤 것이 산화 전극의 반응이고 어 떤 것이 환원 전극의 반응인지를 구별해야 합니다. 갈바니 전지가 형성이 되기 위해서는 자발성이 더 큰 쪽의 반쪽 반응이 정반응으로 일어나야 나머지 한 쪽이 역반응으로 일어나도 자발적인 전지가 형성이 되기 때문에 E 값이 더 작은 위쪽의 반응식이 산화 전극의 반응식임을 알 수 있습니다.

그러면 이제 알았으니 환원 전극에서 환원되는 물질을 찾아줄 수 있습니다. (저는 한눈에 쉽게 보이게 하기 위해서 두 반응식을 정렬하여 다시 썼지만, 실제 문제를 풀 때는 위처럼 반쪽 반응식을 정렬하여 쓸 필요는 없습니다.) 환원 전극에서 환원되는 물질은 PbO2이므로 정답은 4번 또는 5번 중 하나임을 알 수 있습니다.

아직 사용하지 않은 힌트는 문제에서 제시한 pH에 따른 전극의 전위 그래프 뿐이므로 그래프 식을 얻기 위해 네른스트 식을 써봅시다. 그러면 위처럼 로그를 둘로 나누어 한 쪽을 pH에 대한 식으로 나타낼 수 있습니다. 주어진 그래프에서 x축 변수가 pH이기 때문에 빨간색 동그라미를 친 부분이 그래프의 기울기가 됨을 알 수 있습니다.

환원 전극 반쪽 반응식에서도 마찬가지로 네른스트 식을 써주면 위처럼 그래프의 기울기를 나타내서 쓸 수 있습니다. 그러면 그래프의 기울기에 해당하는 값이 0.0592/2 * 4임을 알 수 있습니다. (그래프의 기울기가 양수로 나타났기 때문에 마이너스 부호는 빼고 계산했습니다.)
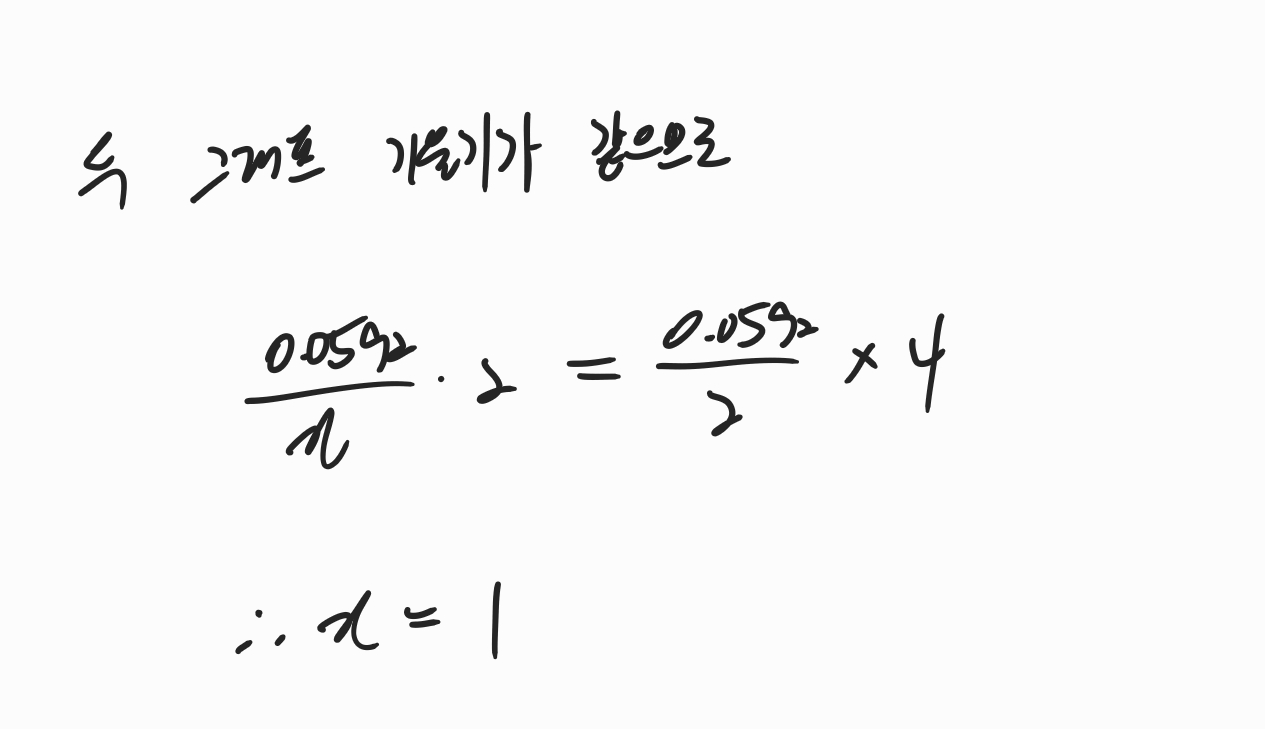
문제에서 제시해준 두 그래프가 평행하기 때문에 두 그래프의 기울기가 같음을 알 수 있습니다. 따라서 두 그래프의 기울기가 같다는 식을 놓고 x값을 구해주면 반쪽 반응식에서 이동한 전자의 수가 1개임을 알 수 있습니다.
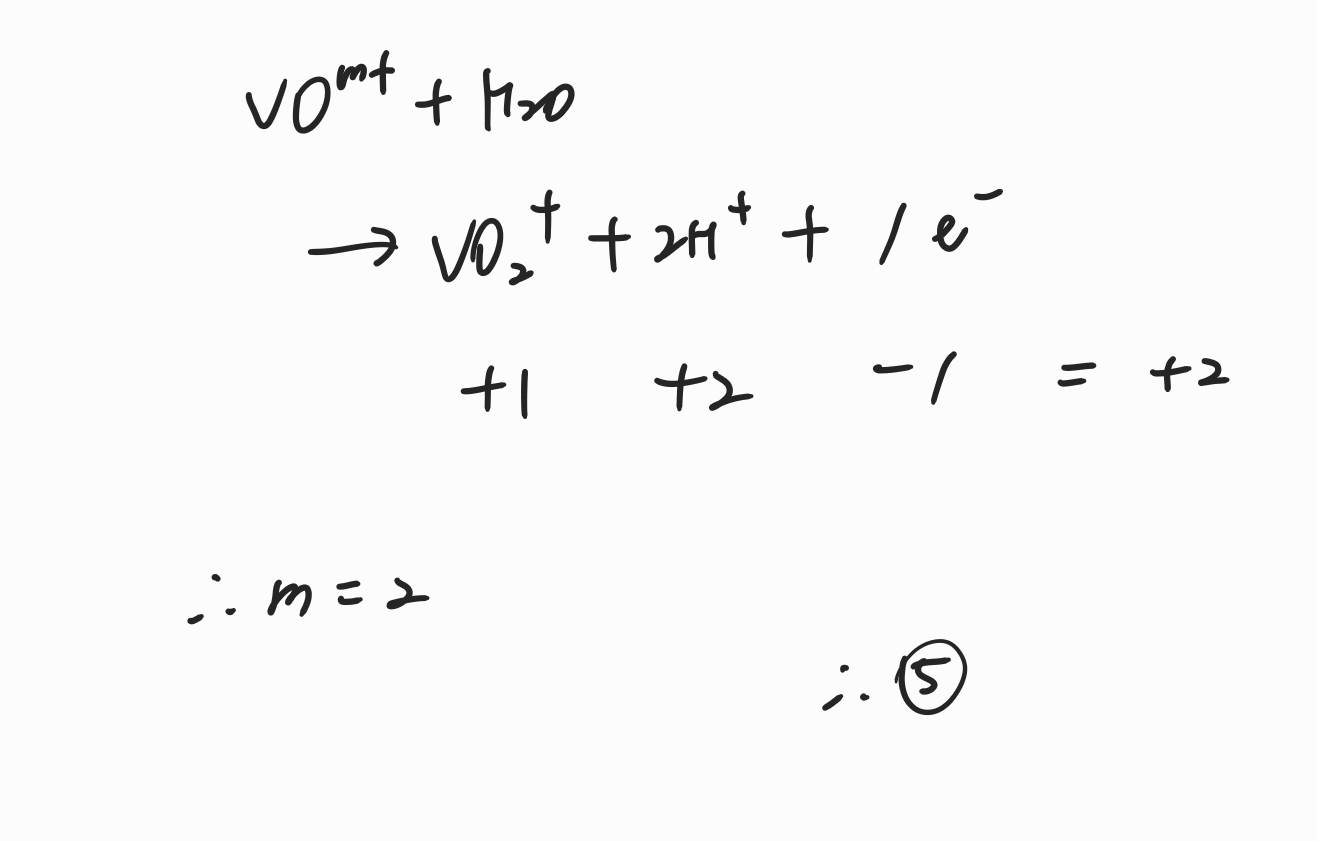
그러면 위와 같이 반쪽 반응식에서 x값을 채운 뒤 전하 균형을 이용하여 m값이 무엇인지 찾아줄 수 있습니다. 계산해보면 m=2이므로 정답은 5번임을 알 수 있습니다.
'자연과학(PEET) > 일반화학' 카테고리의 다른 글
| [PEET 일반화학] 2019학년도 9회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.08 |
|---|---|
| [PEET 일반화학] 2018학년도 8회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.06.06 |
| [배위화학] 빈 오비탈만 알려주고 화합물의 특성을 찾는 문제 (2017학년도 18번 풀이) (0) | 2021.03.03 |
| [배위화학] 배위화합물 구조를 알려주고 특성을 묻는 문제 (2021학년도 8번 풀이) (0) | 2021.03.03 |
| [화학평형] 용해도곱상수를 주고 공통이온효과를 묻는 문제 (2014학년도 13번 풀이) (0) | 2021.03.02 |