1번

결합 에너지, 결합 엔탈피를 이용해서 계산할 때는 반응물 - 생성물로 한 번 뒤집어서 계산해줘야 합니다.
그 외 나머지 에너지들은 모두 생성물 - 반응물입니다.
3번

분자 오비탈 이온화에너지는 위와 같이 결합성 오비탈 > 일반 원자 오비탈 > 반결합성 오비탈입니다.
그리고 같은 분자의 이온화에너지는 전자 많은 쪽(예를 들면 CN > CN-)이 더 작습니다.
7번

H2O 생성 엔탈피를 이용하기 위해서는 반응물을 가장 안정한 상태의 화합물들로 구성할 필요가 있습니다.
△G = -nFE임을 이용해서 n 값이 틀리지 않도록 주의합니다.
전위는 세기 성질이므로 몰수가 늘어난다고 해서 반응식의 E 값이 변화하지 않습니다.
따라서 반응식 전체 계수가 절반이 되거나 두 배가 되는 것은 E 값에 영향을 주지 않습니다.
8번

네른스트 식을 작성할 때 되도록이면 P = 1atm이거나 농도가 1M인 것들은 식에서 빠르게 제외하고 작성해주면 시간을 조금이나마 줄일 수 있습니다.
log가 포함된 식에서는 pK_a ↔ K_a 변형 과정에서 부호와 분모 분자 구분에 주의해야 합니다.
염 첨가는 전위에 영향을 주지 않는다고 생각할 수도 있겠지만 실제로는 그로 인해 불용성 염이 생성될 수 있으므로 확인하고 넘어가야 합니다.
9번

기체 반응 문제에서 비율만 따져도 되는 값들은 다른 조건들을 모두 간소화 하는 것이 중요합니다.
예를 들면 RT = 1로 두어 PV = n이 되도록 한다던가 피스톤 좌우 부피가 a, 2a이면 그냥 1L, 2L로 생각해도 됩니다. (a를 정확히 구해야하는 상황이 아니라는 가정 하에)
15번

꼭 반감기가 일정하지 않더라도 생성물이 일정 "비율"로 감소하기만 하면 반응물에 대한 일차 반응입니다.
문제에서 생성물 변화량만 알려줬으므로 이것은 감소한 반응물의 두 배라는 식을 이용해서 계산을 진행합니다.
또는 등비수열 급수 식을 써서 계산해줘도 무관합니다.
16번

반응물 또는 생성물에 대한 값을 시간에 따라 나타낸 그래프에서 변화가 빨리 나타나는 쪽이 무조건 높은 온도입니다.
위의 그래프에서는 온도를 높였는데 생성물의 농도가 감소했으므로 정반응이 발열 반응임을 알 수 있습니다.
속도 상수의 비로 무언가를 계산해야 할 때는 되도록이면 lnk에 대한 식을 활용해서 활성화 에너지를 활용해주도록 합니다.
17번

G 값과 -RTlnK 식과 H-TS 식을 항상 세 가지 모두 생각하고 있다가 적재적소에 사용해주도록 합니다.
18번

G 값이 0보다 크면 K 값이 1보다 작다고 활용할 수 있으며, 이를 K_c 값과 비교하여 △n_g 값이 양수인지 음수인지 알 수 있습니다.
평형 상수의 비교는 T와 △H값을 이용하여 따져줍니다.
예를 들어 정반응이 흡열 반응인데 온도를 조절했더니 역반응이 진행된다면 온도가 내려간 것입니다.
19번

반응물과 생성물의 기체 몰수가 동일하다면 압력의 변화가 생겨도 K 값이 그대로 유지되므로 반응물과 생성물의 몰수 변화가 나타나지 않습니다.
보기에서 어떤 값이 몇이냐고 물었을 때 그 값이 맞다고 가정하고 확인하는 것보다 그냥 미지수를 계산하는 쪽이 빠를 수도 있습니다.
20번

정상 끓는점에서 그 기체의 증기압은 항상 1atm이고, 여러 온도에서의 증기압을 비교할 때는 위와 같이 lnP와 1/T에 대한 직선 식을 이용해서 기울기와 y 절편을 구해준 뒤 값을 계산해주면 됩니다.
기체가 혼합된 상태에서도 특정 기체에 대해서만 PV/T 일정을 사용할 수 있습니다.
21번
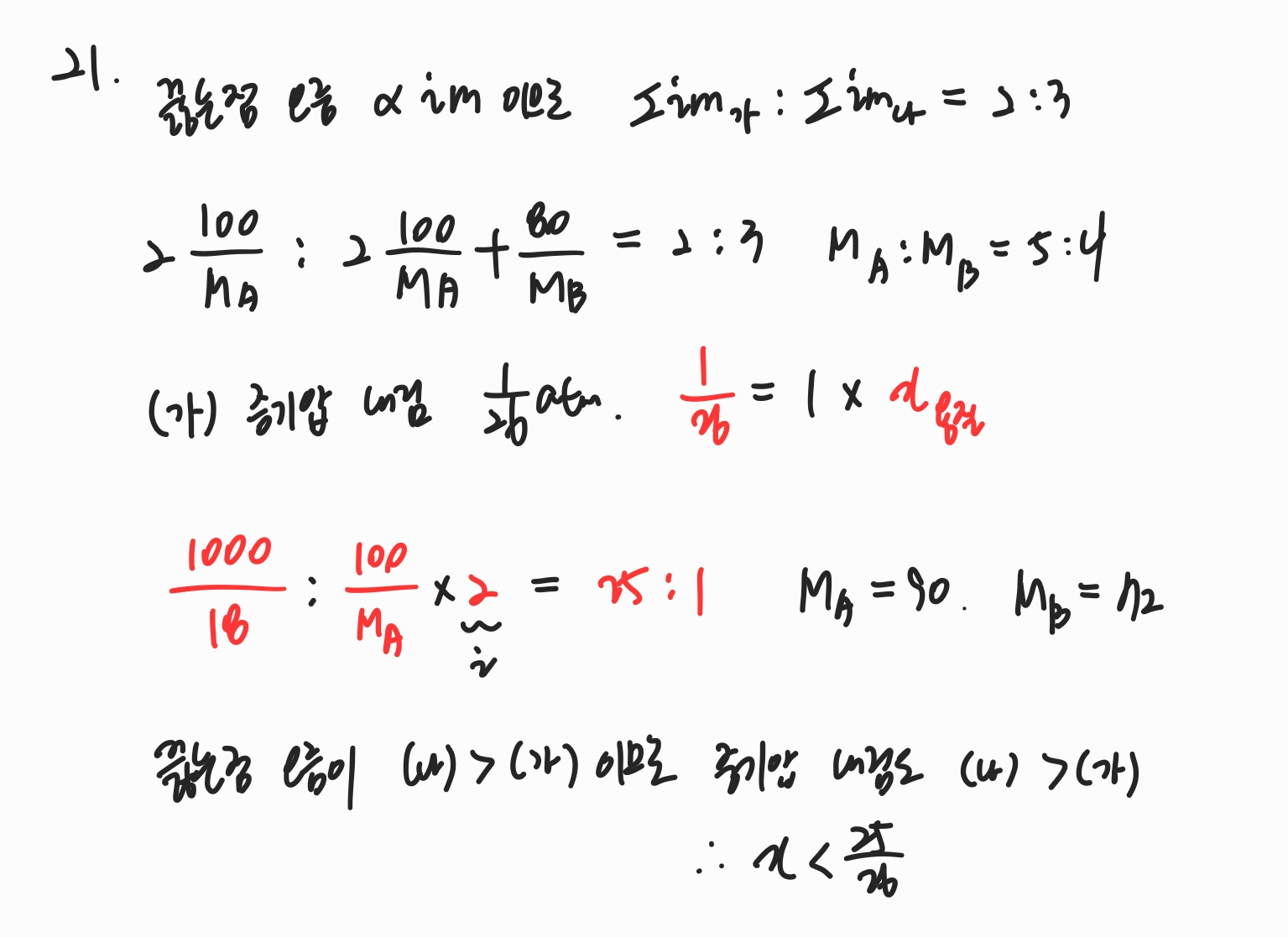
끓는 점 오름은 im 값에 비례합니다.
증기압 내림도 im 값에 비례하지만 그것보다도 증기압 내림이 용질 몰분율에 비례한다는 식이 더 활용도가 높습니다.
이 때 증기압 내림은 용질 몰수에 반트호프 인자를 곱한 것만큼 더 내려가기 때문에 이를 반드시 고려해주어야 합니다.
23번

산염기 문제는 [H+] = (cK_a)^(1/2)이나 당량점에서 n_H+ = n_OH- 식만 사용할 줄 알아도 상당수의 문제를 쉽게 해결이 가능합니다.
24번
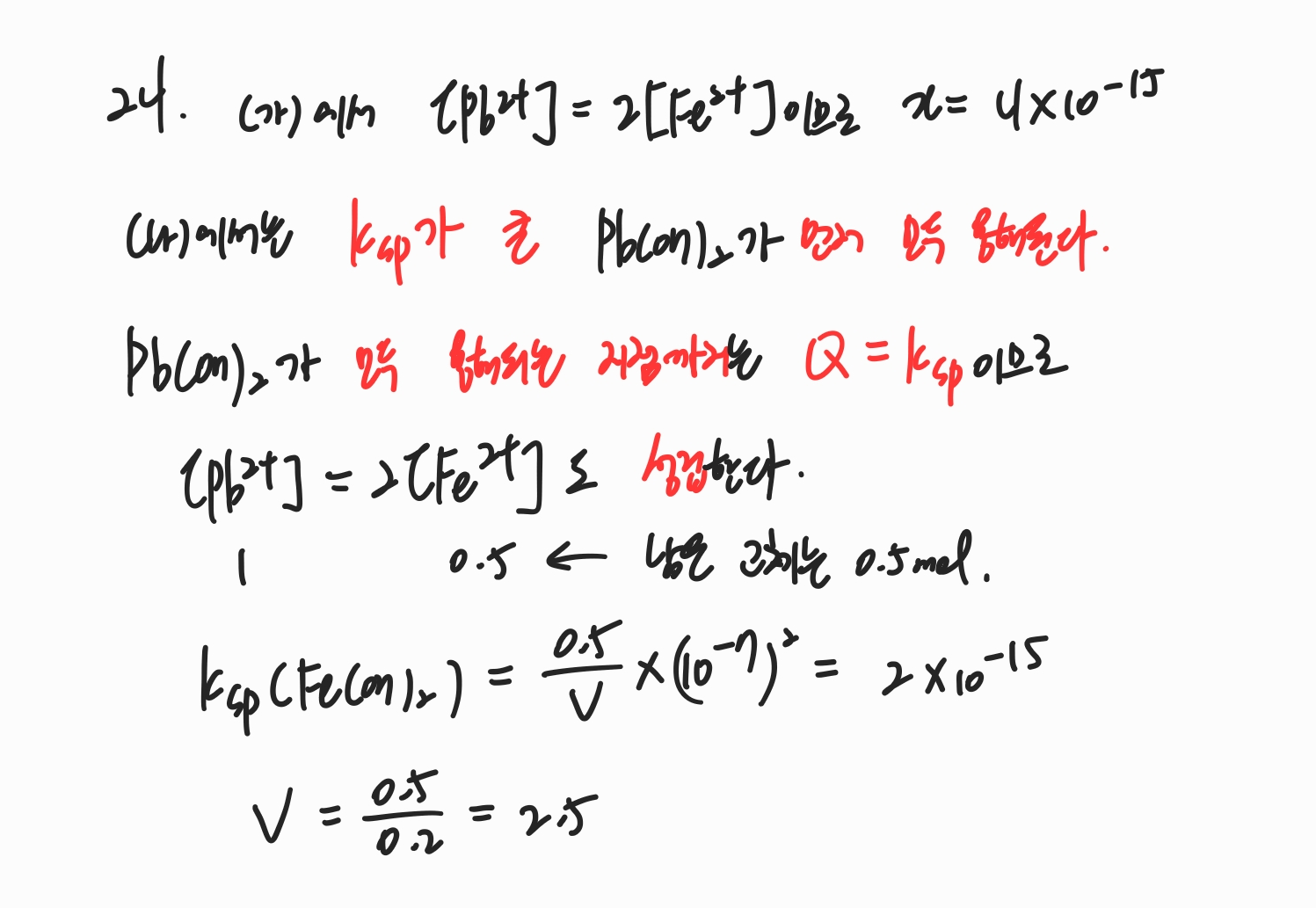
공통 이온을 가지는 K_sp가 다른 두 염이 있을 때 공통 이온의 농도를 낮춰가면 K_sp가 큰 염이 먼저 모두 용해됩니다. (염의 용해를 제한하는 K_sp 값이 더 크니까 당연히 먼저 다 녹습니다.)
염이 모두 용해되는 정확한 지점에서도 Q = K_sp가 성립하기 때문에 식들을 그대로 이용할 수 있습니다.
25번

Z = PV/nRT 이므로 상황에 따라 Z 값의 비를 구할 수 있습니다.
이 문제에서는 RT 값을 알 수 없으므로 이상기체를 찾는 과정이 먼저 진행되어야 했습니다.
'자연과학(PEET) > 일반화학' 카테고리의 다른 글
| 일반화학 문제 풀이 노트 필기 001 : 1차/2차 이온화 에너지 경향성, 산염기 공식적용, 배위화합물 이성질체 등 (2) | 2021.07.26 |
|---|---|
| [PEET 일반화학] 2022-2 일반화학 문제 풀이 노트 필기 (0) | 2021.07.25 |
| [PEET 일반화학] 2017학년도 7회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.22 |
| [PEET 일반화학] 2016학년도 6회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.21 |
| [PEET 일반화학] 2015학년도 5회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.21 |