2016학년도 3번


이온화 에너지와 전자친화도에 관한 문제이지만 이온화 에너지의 예외, 전자진화도의 IE와의 차이점, 그리고 주기율표 상에서 왼쪽 위 원소와 오른쪽 아래 원소의 이온화 에너지 비교를 모두 알아야 풀 수 있는 문제입니다.
우선 기본적으로는 주기율표에서 오른쪽 위로 갈수록 IE, EA 모두 증가하지만 EA는 대체로 들쭉날쭉하기 때문에 IE를 판단의 기준으로 두는 것이 보다 정확합니다. (물론 B-C, O-F와 같이 중간에 예외인 부분을 알아둬야 합니다.)
그리고 왼쪽 위 원소가 오른쪽 아래 원소보다 IE가 큽니다. (즉, 낮은 주기가 우선입니다.)
따라서 이를 기준으로 판단하면 A~D 순서대로 S, Cl, O, F입니다.
① O는 F보다 EA가 작습니다.
② 반지름이 가장 작은 것은 가장 오른쪽 위에 위치한 F, 즉 D입니다.
③ 전기음성도는 F > Cl입니다.
④ 제2이온화 에너지도 IE1과 경향성이 비슷합니다.
따라서 O의 IE2 > F의 IE2입니다. (중간에 이온화 에너지가 역전되는 부분인 O-F 부분에 해당함)
⑤ 유효 핵전하는 O < F입니다.
따라서 정답은 3번입니다.
2016학년도 4번


용해도 C = kP_O2 즉 O2의 분압에 비례하므로 O2 용해도는 0.2 : 0.6임을 알 수 있습니다.
또한 용해되는 기체의 몰수는 용액의 부피에 비례하므로, 용해된 O2 몰수의 비 x/y = (0.2 × 0.4) / (0.6 × 0.8) = 1/6입니다.
따라서 정답은 1번입니다.
2016학년도 5번


이 문제의 조건 상 팽창 과정이 비가역 등온 과정이라고 하였으므로 온도 변화량은 0이고, 따라서 내부 에너지 변화량 또한 0입니다.
따라서 Q = W이고 비가역 팽창에서 W = P_ex × △V이므로, V의 비율을 각각 구해서 이를 Q_1/Q_2 식에 대입해주면 됩니다. (이 때 P_ex는 나중 압력을 대입해주어야 합니다. 즉, 추를 1개 제거했다면 추 1개가 제거된 시점에서의 압력을 말합니다.)
계산하면 답은 3/4가 나오므로, 정답은 3번입니다.
2016학년도 6번


① 문제에서 HA는 약산이라고 하였고, KOH는 강염기이므로 알짜 반응식은 HA와 OH- 사이의 반응이 됩니다.
② HA는 약산이므로 당량점에서 A- 중 일부는 다시 HA로 변환됩니다.
K+ 이온은 전부 K+ 상태 그대로 존재하므로 K+ > A-입니다.
③ 당량점에서 KOH는 0.2M × 10mL = 2mmol이 소모되었고, 농도는 2mmol / 20mL = 0.1M입니다.
이것은 [A-]와 같으므로 [A-] = 0.1입니다.
K_b = x^2 / 0.1 = 10^(-9)이고, x에 해당하는 [OH-] = 10^(-5)이므로, pH = 9.0입니다.
④ A-는 약산의 짝염기이므로 강염기입니다. (즉 H3O+와 A-가 있으면 H+가 A- 쪽으로 넘어갑니다.)
⑤ ③에서 HA는 2mmol인데 이것이 xg이라고 하였으므로 HA 1mol은 500xg입니다.
따라서 정답은 5번입니다.
2016학년도 11번


여러 근거들을 기반으로 분자의 루이스 구조를 찾는 문제입니다.
이 문제에서 가장 중요한 포인트는 "원자가전자 수의 합"이란 각각의 원자들의 원자가전자 수를 말하는 것입니다.
그도 그럴것이 만약 분자의 공유결합에서 중복되는 전자는 제거하고 셀 경우 라디칼이 아닌 이상 홀수가 나올 수가 없습니다.
따라서 원자가전자 수의 합이 15라는 근거를 기반으로 분자식을 세우면 CNO-임을 알 수 있습니다.
중심 원자로 가능한 것은 C와 N이 있으며, 순서대로 (나), (가)에 해당함을 알 수 있습니다.
ㄱ. (가)에서 중심 원소는 질소입니다.
ㄴ. (가)에서 Z(산소)의 형식 전하는 -1입니다.
ㄷ. (나)에서 X(탄소)의 혼성궤도함수는 sp입니다.
따라서 정답은 7번입니다.
2016학년도 13번

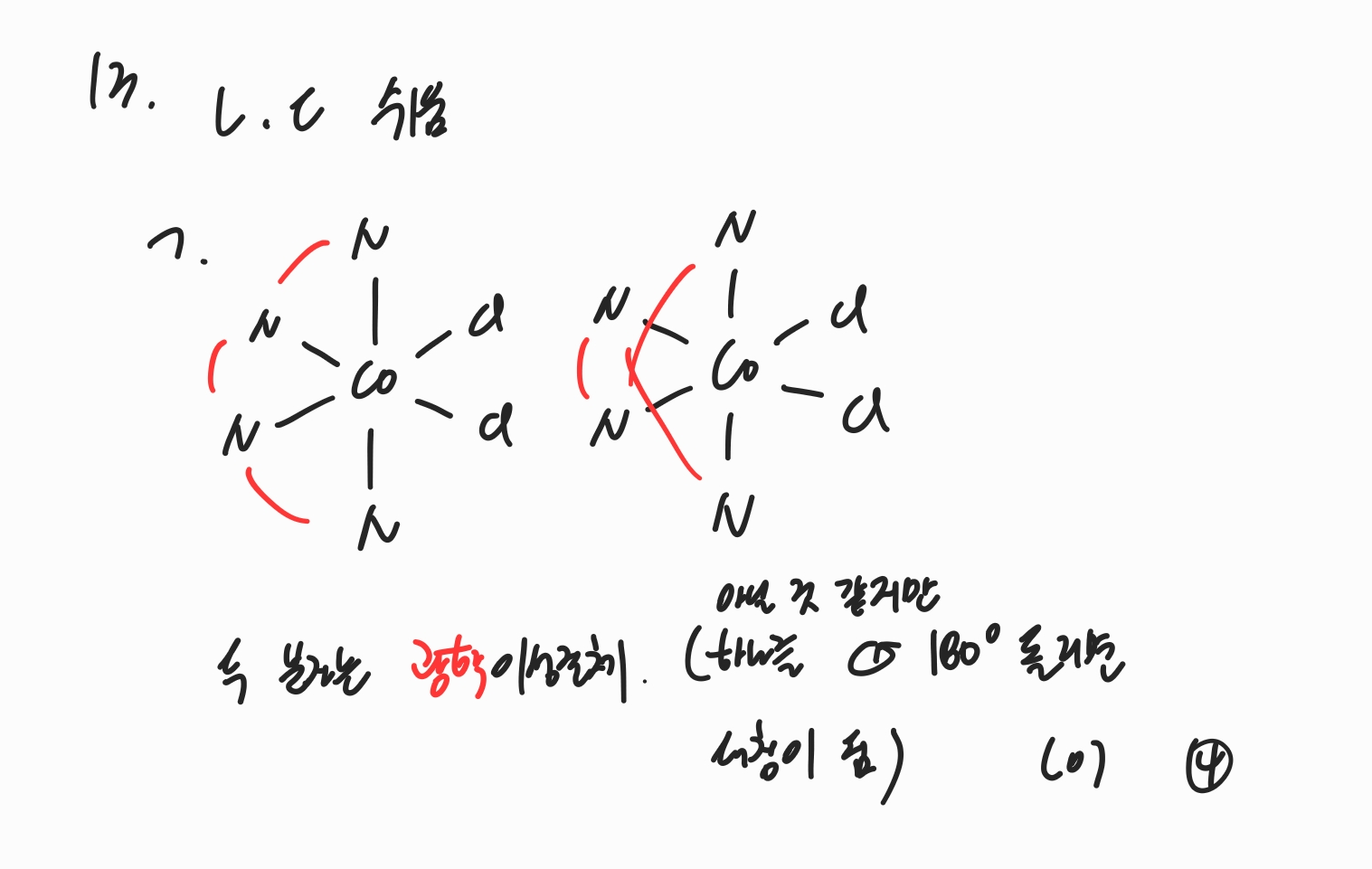
문제 자체는 어렵지 않으나, 보기 ㄱ에서 네 자리 리간드에 해당하는 trien이 어떻게 연결되는지를 주의깊게 보아야 광학이성질체에 대한 판단을 헷갈리지 않고 할 수 있습니다.
문제에서 제시된 분자 (가)와 (나)는 서로 광학이성질체 관계입니다.
따라서 정답은 4번입니다.
2016학년도 17번


ㄱ. AgNO3 분자량이 NaI보다 크므로 (가)의 용질 몰수가 (나)의 용질 몰수보다 적습니다.
어는점 내림 ∝ im이므로 (나)의 어는점이 더 낮음을 알 수 있습니다.
ㄴ. 용질은 용액이 증발한다고 하여 이동하는 것이 아니므로 용질 그대로 비교하면 됩니다.
그런데 용액 (다)에서는 Ag+와 I-가 침전을 형성하므로 (다)에 녹아있는 용질이 가장 적고, 따라서 (다)의 증기압이 가장 높습니다.
그러므로 평형에서 (다)의 용매가 가장 적을 것입니다.
ㄷ. 용매는 세 용액의 증기압이 모두 같아질 때까지 이동하게 되고, 증기압 ∝ 몰랄 농도이므로 세 용액의 몰랄 농도는 모두 같습니다.
따라서 정답은 2번입니다.
2016학년도 18번


ㄱ. (나) 용액에서 AgCl과 AgBr 모두 침전이 일어납니다. (자세한 것은 보기 ㄴ에서 다룸)
ㄴ. 먼저 Ag+를 기반으로 두 음이온 사이에서 일어날 수 있는 알짜 이온 반응식은 AgBr + Cl- → AgCl + Br-이며, 이 반응식의 평형 상수는 K_sp(AgBr) / K_sp(AgCl)이므로 이를 계산하면 4 × 10^(-3)이 나옵니다.
이것은 AgBr의 침전이 우선으로 더 많이 일어남을 의미합니다.
(가)에서 [Ag+] = [Br-] = 0.01M으로 같으므로 AgBr이 먼저 침전되면 [Cl-] = 0.02M입니다.
위에서 구한 평형 상수 값은 [Br-] / [Cl-]이기도 하므로 [Cl-] = 0.02를 대입해주면 [Br-] = 8 × 10^(-5)입니다.
(나)에서는 Br- 침전이 끝나더라도 Ag+이 0.01M 남기 때문에 이것이 Cl-과 반응하여, Cl-은 0.01M이 남습니다.
이것 역시 K 식에 대입해주면 [Br-] = 4 × 10^(-5)M이 됩니다.
따라서 두 용액에서 [Br-]은 (가)가 (나)의 2배임을 알 수 있습니다.
ㄷ. (다)에서 AgCl, AgBr 둘 다 0.1M이 생성됩니다.
알짜 이온 반응식을 써보면 AgCl + 2NH3 → Ag(NH3)2+ + Cl-가 되며, 이 반응식의 K 값은 K_sp(Cl-) × K_f = 4 × 10^(-3)입니다.
또한 Br에 대한 반응식도 똑같이 구해보면 K = 1.6 × 10^(-5)입니다.
AgCl이 더 많이 소모되므로 AgCl의 몰 수 < AgBr의 몰 수임을 알 수 있습니다.
따라서 정답은 1번입니다.
2016학년도 19번


ㄱ. 동일 반응에 대한 E_a 값은 농도와 관련없으므로 반응의 활성화 에너지는 A와 B에서 같습니다.
ㄴ. 평균 반응속도는 (농도 변화량) / (시간 변화량)이므로, C에서 생성된 [CH3COOH]가 A보다 크기 때문에 0~5분의 평균 반응 속도는 C에서가 A에서보다 큽니다.
ㄷ. H+는 이 반응에서 촉매로 작용하므로 k' = k[H+]^n 꼴로 둘 수 있고, t_(1/2) ∝ 1/k' ∝ 1/[H+]^n 입니다.
그러므로 [HCl]이 더 큰 B의 반감기가 더 짧음을 알 수 있습니다.
따라서 정답은 4번입니다.
2016학년도 22번


ㄴ, ㄷ. 어렵지 않게 해결할 수 있습니다.
ㄱ. 문제에서 반쪽 반응식이 아닌 ClO3-이 Cl-로 환원되는 반응에 대해서 물었으므로 ClO3- → Cl- 반응에 대해서 전자의 이동을 계산해야 합니다.
Cl의 산화수가 5에서 -1로 감소하였으므로 ClO3- 1mol당 전자 6mol이 필요함을 알 수 있습니다.
2016학년도 23번


ㄱ. 0.1M B 10mL를 0.1M HCl로 적정하므로 당량점은 10mL, 20mL입니다.
7.5mL에서 B 1mmol과 H+ 0.75mmol이 반응하여 B 0.25mol, BH+ 0.75mol이 만들어지므로 헨더슨-하셀바흐 식에 대입하면 pK_a2 = 11입니다.
15mL에서 헨더슨-하셀바흐 식에 변수들을 대입하면 pK_a1 = 5입니다.
pK_b1 = 14 - pK_a2이므로 이를 참고하여 계산하면 K_a1 < K_b1입니다.
ㄴ. 5mL에서 B 1mmol과 H+ 0.5mmol이 반응하여 B 0.5mmol과 BH+ 0.5mmol이 만들어집니다.
여기에 -OH 0.1mmol을 첨가하면 B는 0.6mmol, BH+는 0.4mmol이 만들어집니다.
pH의 변화량에 대해 물었는데 이는 뒤의 log 항만 고려해주면 되고, log(0.5/0.5)에서 log(0.6/0.4)로 변화하였으므로 pH는 log(3/2)만큼 증가하였습니다.
ㄷ. BH+는 이양성자산이므로 pH = (pK_a1 + pK_a2)/2 = 8이고, 따라서 염기성입니다.
따라서 정답은 7번입니다.
2016학년도 24번


ㄱ. (나)가 끝난 후 수용액에는 KI, Na2S2O3, 녹말 지시약이 들어 있습니다.
녹말 지시약은 I-가 아닌 I2와 반응하여 청색을 띠기 때문에, 아직은 수용액이 청색을 띠지 않습니다.
ㄴ. 위의 반응식에서 I-는 I2로 산화되므로 S2O8 2-는 환원됨을 알 수 있습니다.
ㄷ. 시계 반응은 S2O3 2-가 모두 소모되었을 때 I2가 더 이상 2I-로 환원되지 않기 때문에 청색이 나타나는 원리입니다.
따라서 S2O3 2-가 0.05mmol임을 유추할 수 있고, 반응식의 계수비를 기반으로 따라가보면 SO4 2-는 0.05mmol입니다.
따라서 정답은 2번입니다.
2016학년도 25번


ㄱ. K_p = K_c × (RT)^△n_g이므로 K_c = 75입니다.
ㄴ. C 1mol을 넣은 뒤 형성된 평형이므로 n_C = 0.5로 가정하면 n_A = n_B = 0.5이고 이 때 Q = K인지 확인하면 됩니다.
Q 값을 계산해보면 3으로 K_p에 해당하기 때문에 평형 1에서 C의 몰수는 0.5가 맞음을 알 수 있습니다.
ㄷ. 역시 보기에서 물어보는대로 V_2 / V_1 = 2로 가정을 하고 평형에 해당하는지 확인해보도록 합니다.
부피비를 이용하여 n_1 / n_2를 계산하면 5/6이고, 이를 바탕으로 반응 몰수를 계산하면 A, B는 각 0.3mol씩 반응하였음을 알 수 있습니다.
역시 각각의 분압을 구하여 Q_P 값을 계산해보면 9/16이고 이는 평형 2에서의 K_P값에 해당하므로 부피비는 2가 맞습니다.
따라서 정답은 7번입니다.
'자연과학(PEET) > 일반화학' 카테고리의 다른 글
| [PEET 일반화학] 2022-2 일반화학 문제 풀이 노트 필기 (0) | 2021.07.25 |
|---|---|
| [PEET 일반화학] 2017학년도 7회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.22 |
| [PEET 일반화학] 2015학년도 5회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.21 |
| [PEET 일반화학] 2014학년도 4회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.19 |
| [PEET 일반화학] 2013학년도 3회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.17 |