문제와 해설 모두에 저작권이 있어 스스로 풀이한 문제 풀이 노트 필기본만 정리합니다.
(제가 개인적으로 보려고 정리합니다.)
3번
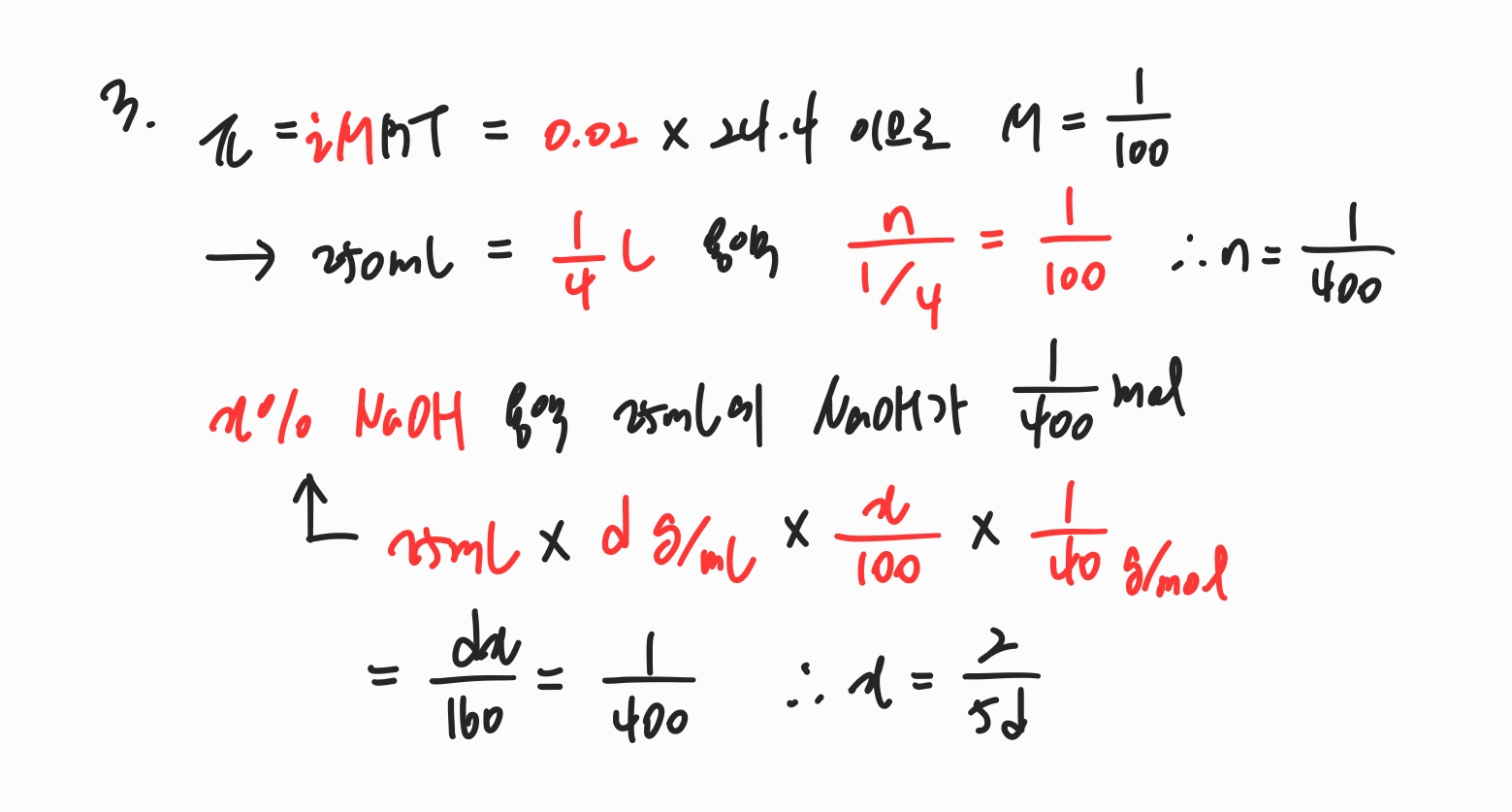
삼투압은 iMRT이므로 항상 반트호프인자를 고려해주어야 합니다.
iM = 0.02라는 식과 용액의 부피를 알면 용질의 몰수를 알 수 있습니다.
x% NaOH 용액에 들어있는 용질의 몰수를 계산할 때는 부피 x 밀도 x 용질의 %값 x 1/(용질 분자량)으로 계산할 수 있습니다.
8번

② HB + H2O → H3O+ + B-의 K_a 값을 안다면 B-의 K_b 값 또한 계산할 수 있습니다.
그런데 수용액 하에서 K_b 값이 1보다 클 수는 없으므로 모든 염기는 -OH보다 약합니다.
③, ④ pH = 5에서 2[HA] = [HB]이므로 pH = 5의 조건에서 [B-]와 [HB]의 비를 계산할 수 있으며, [B-]의 상대적인 값이 아주 작으므로 [HB] = 1M으로 근사할 수 있습니다.
그러나 [HA] = 0.5M으로 근사가 불가능하므로 초기 [HA] = 1M에서 빼서 [A-]를 계산해주도록 합니다.
그러면 HA의 K_a 값을 계산할 수 있습니다.
⑤ HA는 HB보다 강한 산이므로 A-는 B-보다 약한 염기입니다.
따라서 pH는 반대로 NaB가 NaA보다 높습니다.
10번

P = 1atm으로 일정하므로 몰수는 부피에 비례합니다.
편의상 RT = 1로 두어 n = V가 되도록 하면, B를 wg 넣을 때까지는 C가 생성되다가 그 이후로는 반응의 진행이 안되는 것을 알 수 있습니다. (따라서 이 때 A가 모두 소모되었음을 알 수 있음)
그래프 상에서 B는 wg 당 5mol이며, A는 문제 조건에 의해 wg 당 20mol입니다.
따라서 분자량을 "질량/반응몰수"로 계산해주면 1:4:4가 됩니다.
반응 계수는 반응 몰수에 따라 4:1:2가 됩니다.
여기에 문제에서 물어본 B를 3wg 투입한 경우 반응식을 써서 계산해주면 위와 같이 되어 묻는 값을 구할 수 있습니다.
14번

ㄱ. 단일 단계 반응의 경우 계수비를 최소화하기 위해 최대공약수로 나누어질 수 있습니다.
따라서 2단계 반응은 2분자 반응이 맞습니다.
ㄴ. 속도 상수가 작을수록 온도 의존성이 크다고 합니다.
따라서 활성화에너지가 큰 반응의 k가 온도 의존성이 높습니다.
ㄷ. 1단계 반응은 1/2 A + 1/2 B → M이므로 지수는 각각 1/2, 1/2가 되며 전체 반응에서는 3/2, 1/2가 되어 두 지수의 합은 2가 됩니다.
15번

ㄱ. CO(en)3 3+는 광학이성질체만 가지며 기하이성질체는 가지지 않습니다.
즉, CO(en)3 3+의 모든 이성질체는 카이랄하다는 맞는 표현입니다.
ㄴ. Co(dien)2 2+에서 Co의 산화수는 +2, Co(NH3)4Cl2+에서 Co의 산화수는 +3입니다.
Co(NH3)4cl2+에서 Co의 바닥 상태 전자배치는 일반 Co의 전자배치인 [Ar]4s^2 3d^7에서 3개의 전자가 이온화 된 형태인데, 이 때 4s 전자가 먼저 이온화되므로 [Ar]3d^6가 됩니다.
ㄷ. Co(dien)2 2+의 입체이성질체 수는 3개의 기하이성질체와 그 중 하나의 광학이성질체로 총 4개가 존재합니다.
16번
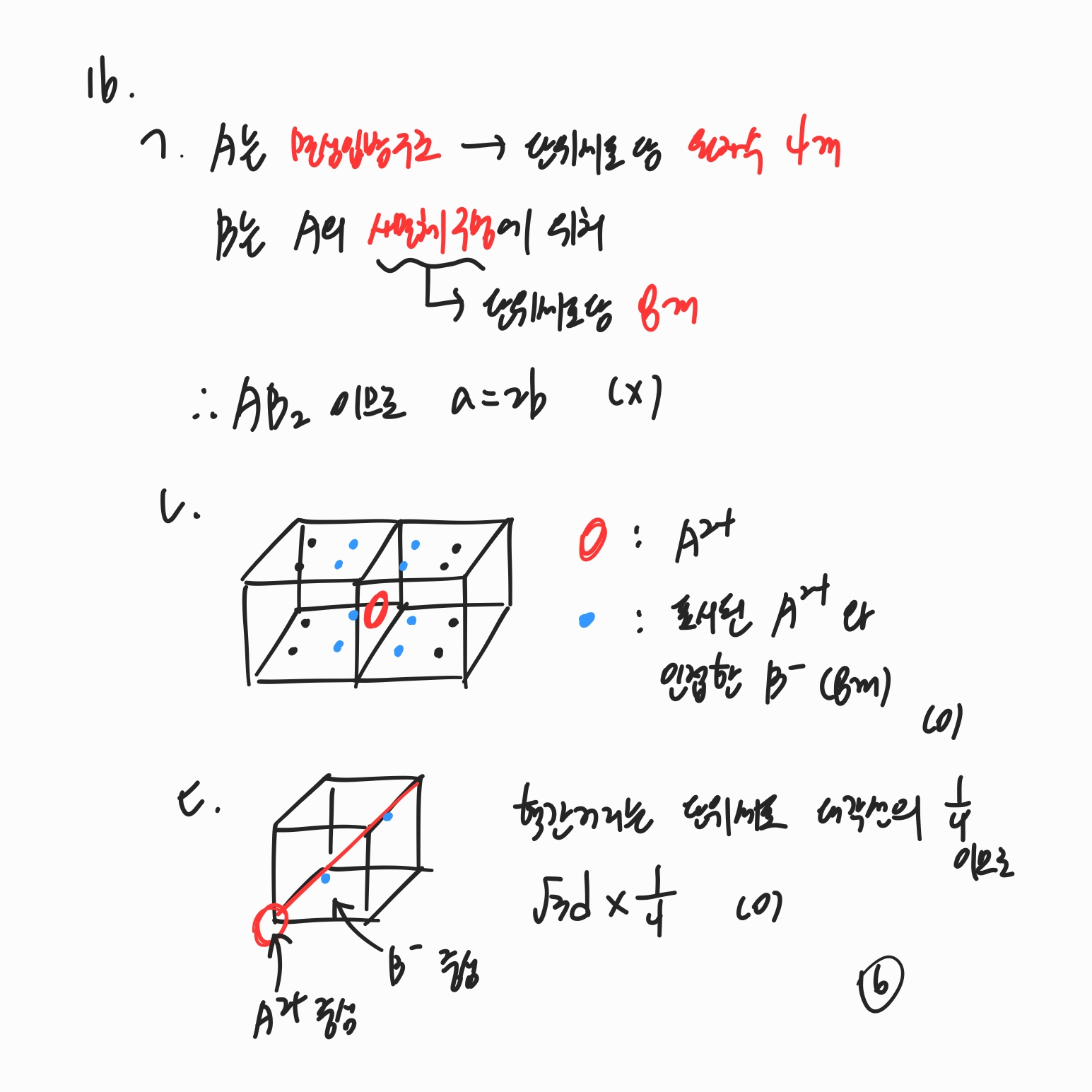
ㄱ. 면심입방구조는 단위 세포 당 원자 수가 4개입니다.
면심입방구조의 사면체 구멍은 단위 세포 당 8개 존재합니다.
ㄴ. 면심입방구조 배열을 가지는 A와 A의 사면체 구멍에 존재하는 B가 있을 때, A에서 가장 가까운 B의 개수는 그림과 같이 8개입니다.
ㄷ. 단위 세포 한 변의 길이가 d일 때, A와 B의 핵간 거리는 단위세포 대각선의 1/4이므로 위와 같습니다.
17번

ㄱ. NaOH는 Na+와 OH-로 해리되므로 i=2이며, 따라서 삼투압을 계산할 때 2를 꼭 곱해주어야 합니다.
ㄴ. 오른쪽 NaOH 수용액에서 H2O만 왼쪽으로 이동할 경우 농도가 증가하므로, 용액의 증기압은 감소하게 됩니다.
이 때 P_tot가 더 증가해야한다면 He의 분압은 증가하므로, 몰분율 또한 증가합니다.
ㄷ. 액체 위에 피스톤을 통해 압력을 가하는 조건에서는 실질적으로 대기압은 배제되고 가해지는 것이므로 헷갈리지 않도록 주의합니다.
19번
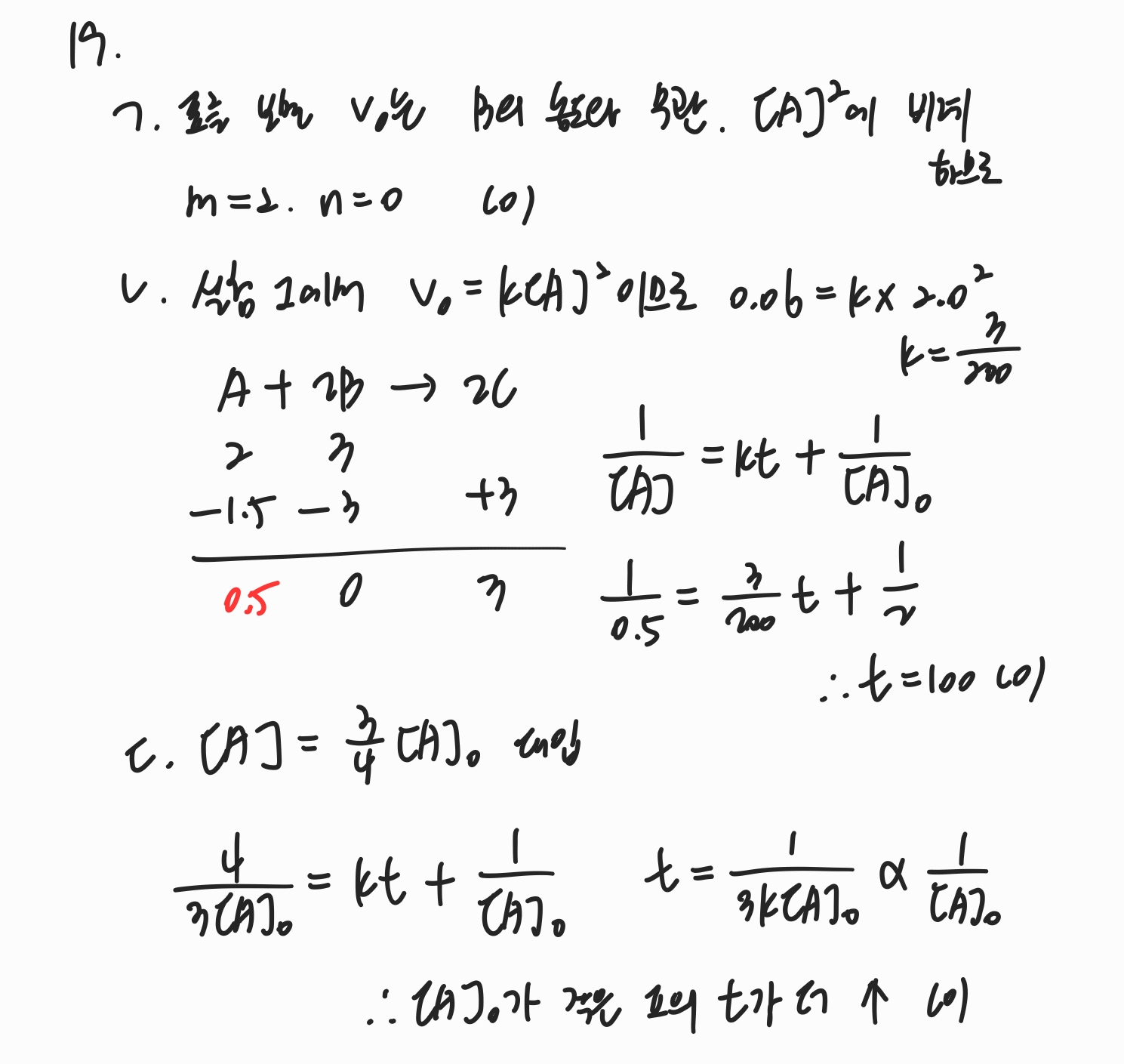
ㄱ. 반응속도론 문제에서는 당연히 표에서 각 물질의 농도에 따른 속도의 변화량을 보고 몇차 반응인지를 판단합니다.
ㄴ. 또한 실험 결과를 통해 농도값과 속도값으로 반응속도 값을 구할 수 있습니다.
반응이 완결되는 시간을 구할 때, 화학양론을 통해 완결된 이후의 물질의 몰수를 계산하여 적분반응속도식에 대입하여 구합니다.
ㄷ. 농도가 초기 농도의 특정 비율을 가지는 시간을 계산할 때는 [A] = x[A]_0 꼴로 대입하여 계산해주면 됩니다.
20번

ㄱ. 고체에서 기체가 생성되는 반응이 있을 때 두 평형에서 압력이 다르다면, Q 값이 다른 것이므로 둘 중 최소 하나는 고체가 아예 남지 않도록 완결된 반응이 있습니다. (Q < K인 상황)
두 평형 중에서 큰 Q가 K 값이 됩니다.
ㄴ, ㄷ. 화학양론을 통해 적절히 계산해줍니다.
23번

ㄱ. 산화 반쪽 반응식과 환원 반쪽 반응식을 적고 전위를 계산해 반응의 표준 전위값을 계산해줍니다.
네른스트식을 이용하여 전지 전위 값이 표준 전지 전위 값보다 큰지 작은지를 판단할 수 있습니다.
ㄴ. 반쪽 반응식을 참고하면 양극이 모두 이온화되므로 질량이 감소함을 알 수 있습니다.
ㄷ. 문제에서 제시한 x값이 어떤 값을 의미하는지 보고, 조건을 상세히 참고하여 문제를 풀이합니다.
역시 네른스트식에 값들을 대입하여 식을 푸는 형식입니다.
24번

ㄱ. 질량분율을 가지고 몰분율을 계산하여 평형상수를 알아내는 문제입니다.
반응식이 2A → B 꼴이라면 B의 분자량은 A의 분자량의 2배이므로, 만약 질량분율이 3:2이라면 몰분율은 3:2/2가 되어 3:1이 됩니다.
온도가 같은 두 평형에서는 K_p 값이 같다는 성질을 이용하여 두 상태에서 압력비를 계산할 수 있습니다.
ㄴ. 평형 상태에서는 △G = 0이므로 △H/△S = T입니다.
정반응이 발열반응이면 동일 압력에서 온도를 높였을 때 역반응이 일어나 생성물의 분율이 감소하게 됩니다.
ㄷ. 피스톤 하에서 반응이 진행될 때는 반응물의 양을 추가하여도 부피만 증가할 뿐 결국 총 압력과 분압은 일정합니다.
따라서 몰분율과 질량분율은 일정합니다.
'자연과학(PEET) > 일반화학' 카테고리의 다른 글
| 일반화학 문제 풀이 노트 필기 002 : 분자 오비탈 이온화 에너지, 기체 반응량 계산, 평형 상수 활용 등 (0) | 2021.07.30 |
|---|---|
| 일반화학 문제 풀이 노트 필기 001 : 1차/2차 이온화 에너지 경향성, 산염기 공식적용, 배위화합물 이성질체 등 (2) | 2021.07.26 |
| [PEET 일반화학] 2017학년도 7회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.22 |
| [PEET 일반화학] 2016학년도 6회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.21 |
| [PEET 일반화학] 2015학년도 5회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.21 |