PEET 유기화학 기출문제 풀이를 하였습니다만 문제와 해설 모두에 대한 저작권자가 존재하므로 개인적으로 필기한 내용만 첨부하여 정리합니다.
+ 유기화학은 개인적으로 어려웠던 메커니즘이나 필요하다고 생각되는 포인트만 정리하였습니다.
2번

① 1,3-diaxial 상호 작용의 크기는 CH3가 CN보다 큽니다.
** 참고 : CH3 > Br > CN
② 위의 양이온 분자는 공명을 통한 안정화를 할 것 같지만, 그보다도 hyperconjugation에 의한 안정화가 일어납니다.
④ 위의 분자는 분자 내 수소결합을 하므로, 수소가 해리가 더 안되기 때문에 산성도는 낮고, pKa는 큽니다.
3번
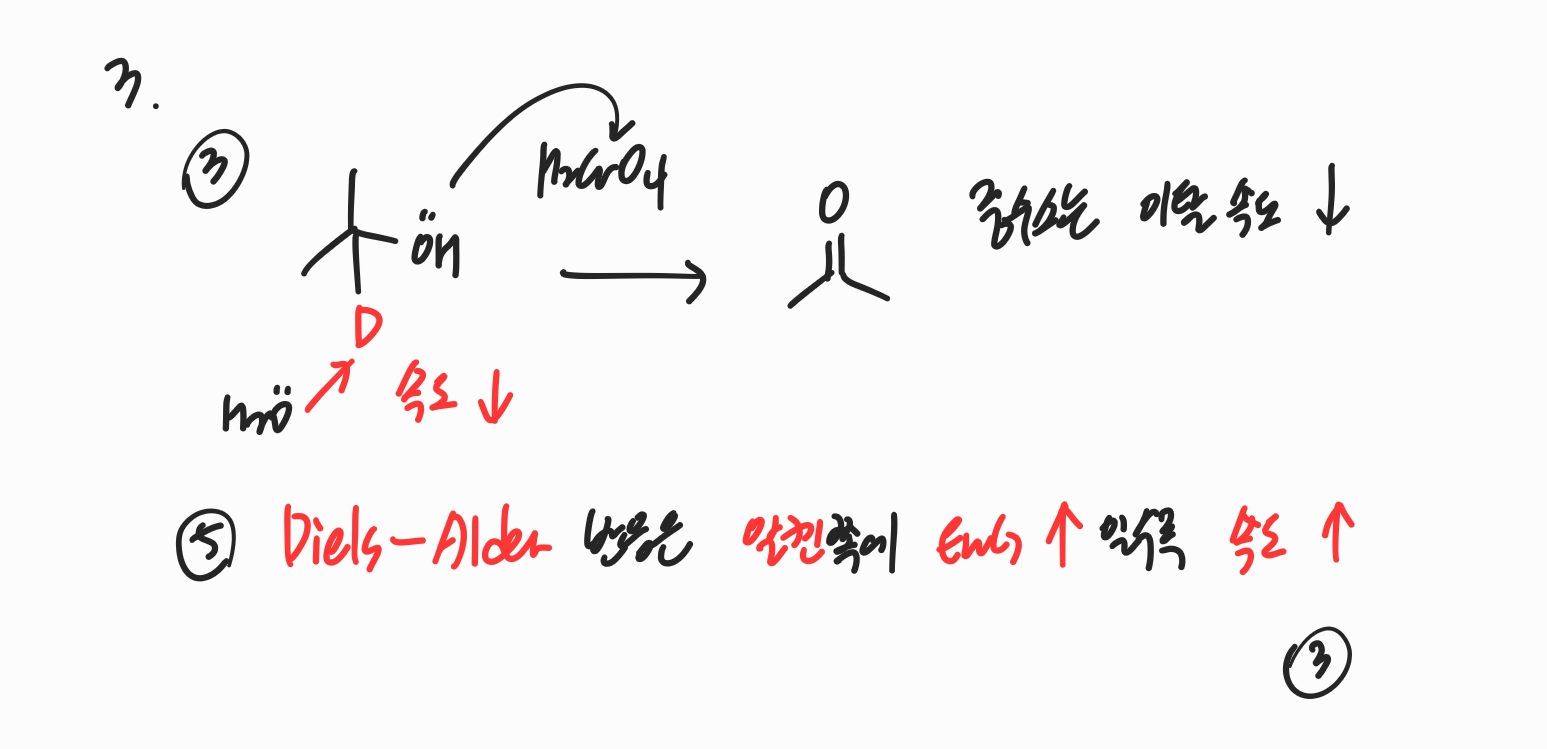
③ 중수소는 염기에 의한 이탈 속도가 수소보다 느리므로 반응 속도가 느립니다.
⑤ Diels-Alder 반응은 알켄 쪽에 EWG가 많을수록 속도가 빠릅니다.
4번

A : H2O(약친핵체) + 2차 RX의 반응에서는 H2O가 SN2를 일으킬 수 없으므로, 분자 내 SN2가 가능할 경우 분자 내 SN2가 일어납니다.
B : H2O가 먼저 SN2를 일으킬 경우, 그 다음 반응 진행이 불가능하므로 분자 내 SN2 반응이 일어납니다.
그 다음 산소 양이온이 형성되므로 그 때 H2O가 SN2 반응을 일으켜 8각 고리를 형성하게 됩니다.
5번

다이엔 고리와 Diels-Alder 반응의 경우 육각 고리를 접어서 반응을 진행시켜야 합니다.
반응 이후 Diels-Alder 반응이 역으로 일어나 고리가 분해되고 다이엔과 알켄으로 나누어지기도 합니다.
8번

A : ClSO3H에서 -OH가 빠지면 E+(친전자체)가 되므로 EAS가 일어날 것을 예상할 수 있습니다.
따라서 첨가될 수 있는 두 개의 자리에 E+를 첨가시켜보면 공명구조가 더 많은 자리로 첨가가 됩니다.
B : 그 다음 친전자체는 첨가될 수 있는 두 자리 모두 2개의 공명구조를 가지지만, 그 중에서 하나는 EWG 쪽에 탄소 양이온이 형성되는 불안정한 공명 구조이므로 그 쪽으로는 반응이 일어나지 않습니다.
+ SO2Cl에 H2O를 가하면 SO3H가 되어 스스로 떨어집니다.
10번

반응물에서 R-이 반응할 친전자체가 없는 경우, RMgBr에서 R-이 사용되는 것이 아닌 +MgBr이 사용됩니다.
또한 Grignard 시약은 무수 조건에서 사용되어야 하므로 용매로 EtOH 등이 사용될 수 없습니다.
NH4+는 H+를 제공하는 산의 역할을 합니다.
메커니즘의 경우 위의 그림을 참고하면 좋습니다.
12번

ㄱ, ㄴ. 쉽게 해결 가능합니다.
ㄷ. Simmons-Smith 반응의 경우 Zn이 안정한 전이 상태를 형성할 수 있는 OH기 등이 있는 경우 steric이 크더라도 그 쪽으로 첨가가 일어나게 됩니다.
생성물을 뒤집어보면 보기에서 제시된 생성물과 일치함을 알 수 있습니다.
13번

ㄱ, ㄴ. 쉽게 해결할 수 있습니다.
ㄷ. 내부 알카인의 경우 알카인 쪽은 회전이 불가능하지만 그 옆 탄소들은 자유롭게 회전이 가능합니다.
두 분자가 거울상 관계에 있더라도 메조 화합물인지 확인을 해주어야 합니다. (메조화합물이면 이성질체가 아님)
문제에서 제시된 보기가 너무 쉬울 경우 다른 경우는 없는지 반드시 의심을 해보아야 합니다.
14번
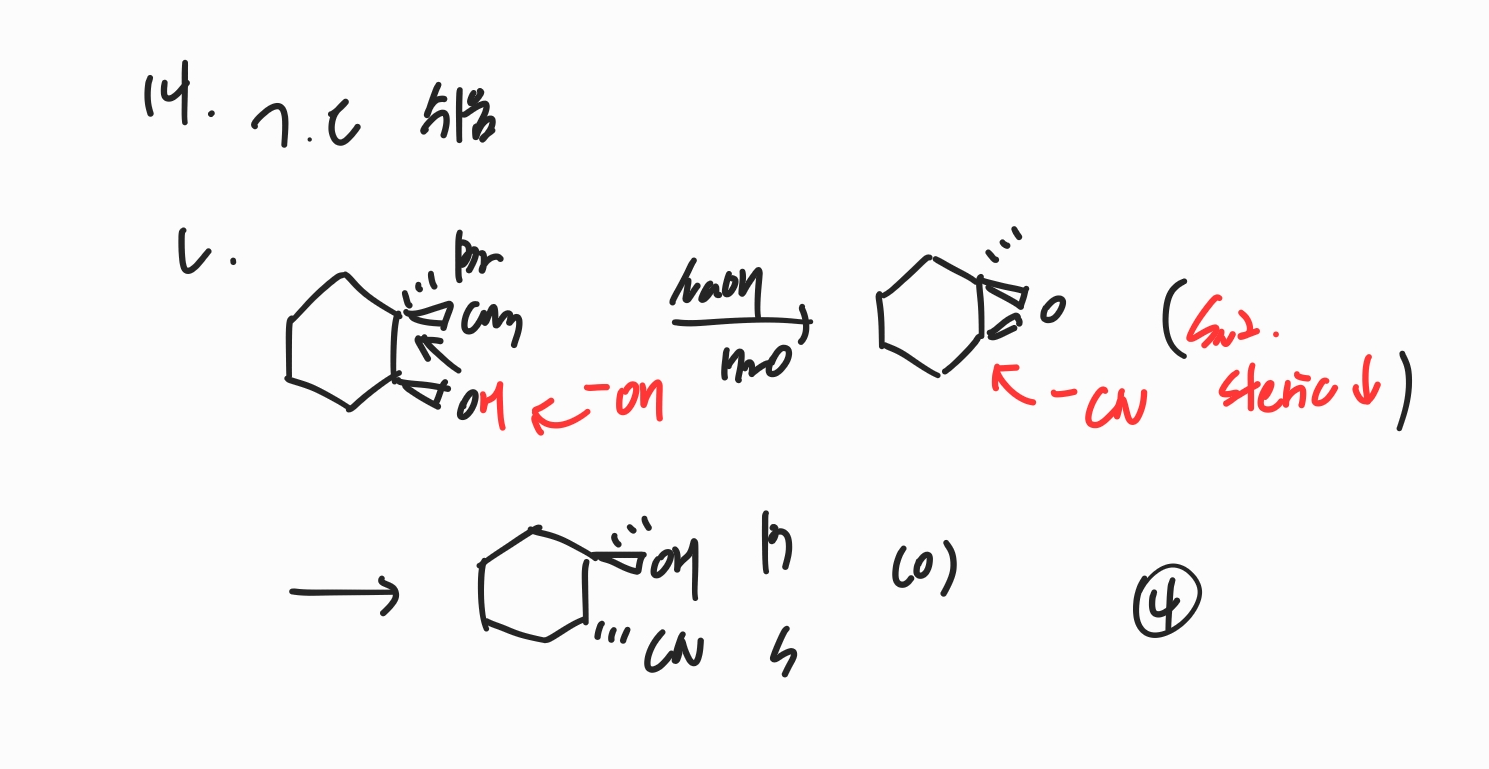
ㄱ, ㄷ. 어렵지 않게 해결할 수 있습니다.
ㄴ. -OH는 친핵성 치환 반응을 하는 것이 아니라 알코올의 수소를 제거하는 역할이고, SN2는 그 다음에 일어납니다.
-CN은 2차 탄소에도 SN2를 일으킬 수 있으며, 따라서 steric이 작은 탄소에 반응합니다.
16번

ㄴ, ㄷ. 쉽게 해결할 수 있습니다.
ㄱ. 분자 내 반응이 가능한 경우는 항상 분자 내 반응이 우선적으로 일어나야 합니다.
(분자 내에서 반응할 곳이 없으면 그제서야 다음 시약이 반응하는 것입니다.)
따라서 보기 ㄱ의 반응물에서 벤젠 고리의 알켄이 OTs를 이탈시키고 삼각 고리를 형성한 뒤, 그 다음에야 -OAc가 반응을 수행합니다.
+ 보기가 너무 쉬울 경우 메커니즘에 대해 의심해보아야 합니다.
17번

ㄴ. 어렵지 않게 해결 가능합니다.
ㄱ. 먼저 -OH에 의해 steric이 작은 수소가 제거됩니다.
그러면 산소 음이온이 분자 내 SN2 반응을 통해 또 다른 에폭사이드를 형성하고, 새롭게 생성된 O-에 수소가 shift하여 O-가 육각 고리를 형성할 수 있게 해줍니다.
그림에서 빨간 색으로 표시한 OH기의 입체 표현에 주의하여 생성물을 그려주면 보기와 일치함을 알 수 있습니다.
ㄷ. 염기가 과량 처리된 경우 일단 다 이온화시키고 생각해야 합니다.
위와 같이 이온화를 시킨 다음 SN2를 통해 가장 안정한 form인 육각 고리를 형성할 수 있는 O-가 육각 고리를 형성하게 됩니다.
19번

ㄱ. HCO3-는 일반적인 염기이므로 steric에 관계없이 가장 산성도 높은 수소를 제거합니다. (= 공명이 많은 음이온)
따라서 위와 같은 위치의 수소가 제거 되고, 그 다음 +C2H5가 첨가되어 반응이 완결됩니다.
ㄷ. 두 OH의 수소 산성도가 비슷하므로 일단 둘 다 진행시켜보면, (i)의 경우에는 생성되는 오각 고리가 strain이 커서 매우 불안정하므로, (ii)의 메커니즘대로 진행되는 것이 옳습니다.
20번
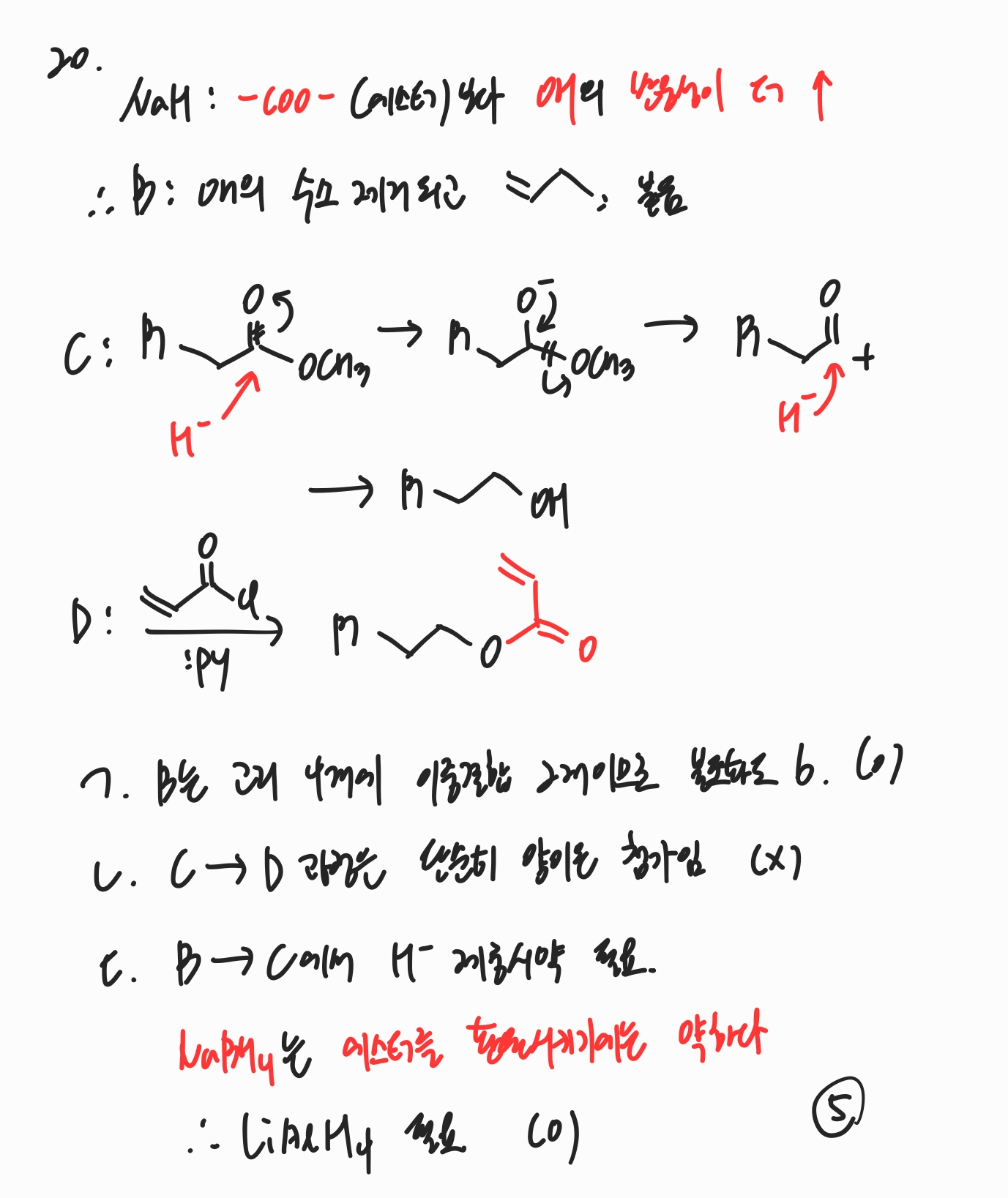
NaH는 -COO-(에스터)보다 OH와의 반응성이 더 높습니다.
따라서 B에서는 OH의 수소가 제거되고 알킬기 음이온이 결합하게 됩니다.
C에서는 H-가 에스터와 반응하여 알코올이 되는 반응이 일어납니다.
D에서는 pyridine에 의해 알코올의 수소가 제거되고, 이 O-가 Cl을 이탈시키며 반응을 완결하게 됩니다.
ㄱ. B는 고리 4개에 이중결합 2개를 가졌으므로 불포화도는 6입니다.
ㄴ. C → D 과정은 단순한 양이온 첨가 과정입니다.
ㄷ. B → C 과정에서 H- 제공 시약이 필요한데, 이 때 NaBH4는 에스터를 환원시키기에는 약한 환원제이므로, LiAlH4가 필요합니다.
'자연과학(PEET) > 유기화학' 카테고리의 다른 글
| 유기화학 문제 풀이 노트 필기 002 : 카이랄성 판단, Diels-Alder exo/endo 배열, 에폭사이드 고리열림 반응 등 (0) | 2021.07.31 |
|---|---|
| 유기화학 문제 풀이 노트 필기 001 : 여러 고리 화합물 배열 찾기, 공명 구조 안정성 비교 등 (0) | 2021.07.29 |
| [PEET 유기화학] 2021학년도 11회 PEET 유기화학 고난도 기출문제 풀이/해설 (0) | 2021.07.22 |
| [PEET 유기화학] 2020학년도 10회 PEET 유기화학 고난도 기출문제 풀이/해설 (0) | 2021.07.21 |
| [PEET 유기화학] 2017학년도 7회 PEET 유기화학 고난도 기출문제 풀이/해설 (0) | 2021.07.17 |