2011학년도 6번
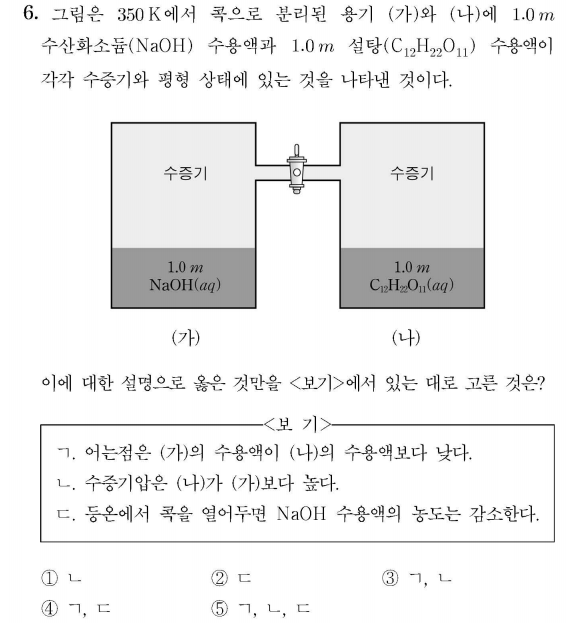

용액의 총괄성에 대한 문제입니다.
용액의 총괄성이란 용질의 성질에 관계없이 입자수에만 비례하여 나타나는 성질을 말합니다.
어는점 내림, 끓는점 오름, 증기압 내림, 삼투압 등이 해당하며 이 중에서 어는점 내림, 끓는점 오름, 증기압 내림은 모두 반트호프 인자 × 몰랄 농도 값에 비례하여 나타납니다.
ㄱ. NaOH의 경우 용액에서 해리하기 때문에 반트호프 인자가 2가 되고, 따라서 NaOH 수용액의 어는 점이 더 낮음을 알 수 있습니다.
ㄴ. 증기압 내림 또한 끓는점 오름, 어는점 내림과 같이 im값에 비례하여 나타나므로, NaOH 수용액의 증기압 내림이 더 큽니다.
따라서 수증기압은 (가) < (나)입니다.
ㄷ. 포도당 용액 증기압이 더 높으므로, 콕을 열면 NaOH 수용액이 응축하여 NaOH 수용액의 농도는 감소합니다.
따라서 정답은 5번입니다.
2011학년도 10번


물질의 엔탈피 관계를 나타내는 말들이 옳은지 판단하는 문제로, 덧셈과 뺄셈, 그리고 계수비만 맞추어 계산하면 어렵지 않습니다.
ㄱ, ㄴ. 쉽게 해결 가능합니다.
ㄷ. 하나의 엔탈피를 다른 엔탈피들의 합과 차로 나타낼 때는 반드시 두 경로의 시작점과 끝점이 같도록 화살표들을 연결한다고 생각합니다.
이 때 반대 방향으로 화살표가 있을 경우 마이너스 부호만 붙여주면 됩니다.
따라서 H5 = -H1 + H2 + H3 + H4이므로, 부호가 반대임을 알 수 있습니다.
따라서 정답은 1번입니다.
2011학년도 11번


EDTA와 이온의 용해도곱 상수 차이를 이용하여 이온의 농도를 알아보는 실험입니다.
ㄱ. (가)의 pH는 10이므로 [OH-] = 10^(-4)이고, (나)의 pH는 13이므로 [OH-] = 10^(-1)입니다.
이를 이용하여 문제에서 제시한 용해도곱 상수를 가지고 부등식을 만들어보면, Ca2+의 농도는 10^(-4)M보다 작다고 하였으므로 Ca(OH)2는 침전하지 않습니다.
그런데 실험 과정에서는 침전이 분명히 일어났다고 하였으므로 침전이 일어난 물질은 Mg(OH)2임을 알 수 있습니다.
ㄴ. 이 실험에서 EDTA2-와 Mg2+나 Ca2+의 착물 형성은 자발적으로 일어납니다.
ㄷ. (가)는 10mL에 Mg2+와 Ca2+가 모두 들어있고, (나)는 8mL에 Ca2+만 들어있으므로 (가)에서 Mg2+는 2mL임을 알 수 있습니다.
따라서 Ca2+가 Mg2+의 4배에 해당합니다.
따라서 정답은 3번입니다.
2011학년도 13번


산화 환원 반응의 경향성을 비교하여 전위 등을 비교하는 문제입니다.
ㄱ. C가 산화, B는 환원되었으므로 C가 B보다 산화되기 쉬움을 알 수 있습니다.
ㄴ. 전하 균형을 맞추면 2B+ + C → 2B + C2+ 인데, 이 때 금속의 질량이 증가하였으므로 2M_B > M_C임을 알 수 있습니다.
따라서 (C의 원자량) / (B의 원자량)은 2보다 작음을 알 수 있습니다.
ㄷ. 그림에서 A2+ 대신 B+가 환원되는 것으로 보아 A2+는 B+보다 환원성이 낮음을 알 수 있습니다.
그리고 HCl에 C를 넣었더니 수소 기체가 발생하였다고 하였으므로, C → C2+ + 2e- 반응의 E > 0임을 알 수 있습니다.
따라서 C의 환원은 자발적이고, C가 산화력에 의해 환원이 된 B의 E < 0임을 알 수 있습니다.
처음에 A는 B보다 환원성이 낮다고 하였으므로 E_A < E_B < 0이므로 A의 표준 환원 전위는 0보다 작습니다.
따라서 정답은 2번입니다.
2011학년도 15번


ㄱ. Cd → Cd2+ + 2e- 반응의 표준 산화 전위는 0.40V, 2AgCl + 2e- → 2Ag + 2Cl- 반응의 표준 환원 전위는 0.22V이므로 이렇게 두 반응이 같이 산화 환원 반응을 일으킬 것임을 알 수 있습니다.
이 때 전자는 Cd에서 Ag | AgCl 쪽으로 이동합니다.
ㄴ. 산화 전극은 Cd가 이온화되므로 질량이 감소합니다.
환원 전극은 AgCl이 Ag+와 Cl-로 이온화되므로 역시 질량이 감소합니다.
따라서 두 전극의 질량은 모두 감소합니다.
ㄷ. 표준 전지 전위는 0.62V인데, 용액에 Cl- 이온이 이미 있고 이 농도가 1M보다 크므로 반응성을 낮추는 역할을 합니다. (생성물이므로)
따라서 초기 전지 전압은 0.62V보다 작습니다.
따라서 정답은 3번입니다.
2011학년도 16번


반응에 대한 그래프를 주고 이를 해석하는 문제입니다.
ㄱ. A가 두 반응의 공동 반응물이고 이것이 각각의 반응을 통해 B 또는 C로 생성이 된다고 할 때, 반응 속도는 두 반응 각각의 속도를 합친 것과 같습니다.
(반응 두 개가 동시에 일어난다고 하여 이를 평균내면 안됩니다. 반응속도는 오직 반응물에 의해 결정되기 때문입니다.)
ㄴ. p < q이므로 C가 더 빨리 생성됨을 알 수 있습니다.
ㄷ. 그래프 식이 lnk = -E_a/RT + lnA이므로 그래프의 기울기는 활성화 에너지에 비례합니다.
따라서 반응 1의 E_a가 더 작음을 알 수 있습니다.
따라서 정답은 1번입니다.
2011학년도 17번


착이온과 자기적 색깔에 대한 문제입니다.
ㄱ. 보색 관계를 간단히 원으로 나타내어보면, 첫 번째 착이온은 노란색으로 보이므로 보색인 보라색 빛을 흡수했음을 알 수 있고, 두 번째 착이온은 빨간색으로 보이므로 보색인 초록색을 흡수했음을 알 수 있습니다.
그렇기 때문에 파장은 갈라짐 에너지에 반비례하므로, 이를 비교하여 첫 번째 착이온의 갈라짐 에너지가 더 큼을 알 수 있습니다.
ㄴ. B가 A보다 약한 장 리간드임에도 불구하고 반자성이기 때문에, 더 강한 장 리간드에 해당하는 A는 역시 반자성임을 알 수 있습니다.
ㄷ. 팔면체 착물이 반자성이기 위해서는 d6(이면서 동시에 강한 장 리간드)이거나, d10일 수 밖에 없습니다.
그런데 중심 금속의 산화수가 +3인 상황에서는 Zn이 와도 d10인 것은 불가능하기 때문에, d10은 아닙니다.
따라서 d6임을 알 수 있고 원자번호를 x로 두고 계산해보면 x = 27이므로 이 때 전자배치는 [Ar] 4s^2 3d^7임을 알 수 있습니다.
따라서 정답은 3번입니다.
2011학년도 18번


오존에 대한 분해 반응식과 반응 그래프를 주고 이를 해석하는 문제입니다.
① 기울기 = k = Ae^(-E_a/RT)이므로 T가 증가하면 기울기 역시 증가함을 알 수 있습니다.
따라서 두 그래프에서 T1 < T2임을 알 수 있습니다.
② 1/t_(1/2) ∝ [O_3]_0이므로 t_(1/2) = 1/k[O_3]_0인 2차 반응임을 알 수 있습니다.
③ t_(1/2) = 1/k[O_3]_0임을 생각하면 반응이 진행될수록 반감기가 늘어남을 알 수 있습니다.
④ v = k[O_3]_0 = [O_3]_0 / t_(1/2) = 10a입니다.
⑤ T_2, [O_3]_0 = a에서 t_(1/2) = 1/50입니다.
따라서 0.04초는 2t_(1/2)이므로 농도는 1/4보다 큽니다.
(이것은 반응이 오존에 대한 2차 반응이므로 반응이 진행될수록 반감기가 늘어나기 때문입니다.)
따라서 정답은 4번입니다.
2011학년도 19번


격자에너지는 NaY < NaZ이므로, F, Cl, Br의 후보가 될 수 있는 Z, Y는 위와 같습니다.
그런데 LiX가 NaY, NaZ 사이의 격자에너지를 가지므로 X = Cl, Y = Br, Z = F임을 예상할 수 있습니다.
가장 헷갈리는 보기만 모아보자면 다음과 같습니다.
③ 결합의 극성은 HCl > HBr입니다.
이것은 단순히 원자의 크기나 산성도를 비교하는 것이 아닌, Cl의 전기음성도가 Br보다 더 크기 때문입니다.
④ 격자 E는 NaF > LiCl인데, LiCl > LiBr이므로 NaF > LiBr임을 알 수 있습니다.
따라서 정답은 4번입니다.
2011학년도 20번


기초적인 화학양론 문제입니다.
ㄱ. C는 B가 6g 이상이어도 더 얻어지지 않으므로 B가 6g일 때 A가 딱 모두 반응함을 알 수 있습니다.
따라서 반응량을 위처럼 작성할 수 있고, 이 때 미지수 x를 적당히 두고 계산하면 A, B, C의 화학식량 비는 3 : 2 : 4.5임을 알 수 있습니다.
ㄴ. 이제 질량비를 알았으니 B의 초기 질량이 2g일 때로 상황을 세워 정리해보면 A, C 화학식량 비가 1 : 2이므로 몰수비는 2 : 3/2임을 알 수 있습니다.
따라서 생성물에서 A의 몰분율은 4/7이 됩니다.
ㄷ. B의 초기 질량이 8g일 때로 식을 다시 세워 계산한 뒤, 이 때 수득량이 50%라 하였으므로 생성물 9g을 절반으로 나누어보면 4.5g이 얻어지는 것이 맞음을 알 수 있습니다.
따라서 정답은 4번입니다.
'자연과학(PEET) > 일반화학' 카테고리의 다른 글
| [PEET 일반화학] 2013학년도 3회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.17 |
|---|---|
| [PEET 일반화학] 2012학년도 2회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.17 |
| [PEET 일반화학] 2021학년도 11회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.08 |
| [PEET 일반화학] 2020학년도 10회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.08 |
| [PEET 일반화학] 2019학년도 9회 PEET 일반화학 고난도 기출문제 풀이/해설 (0) | 2021.07.08 |